
发表期刊: Journal of Translational Medicine
影响因子:7.4
合作单位:山西医科大学
百趣提供服务:新一代代谢组学NGM
手足口病(hand-foot-mouth disease, HFMD)是由多种肠道病毒感染引起的,对儿童构成验证的公共卫生威胁。肠道病毒71(Enterovirus 71, EV71)是手足口病的主要病原体,属于一种肠道病毒。目前手足口病尚无特效药物,仅能通过饮食或饮食成分得到缓解。黄芪通过健肺脾来预防病毒入侵,黄芪皂苷 IV(Astragaloside IV, AST-IV)是黄芪的一种有效活性成分,研究表明AST-IV可抑制多种病毒的复制;然而,AST-IV对EV71病毒复制的抑制作用及其机制尚不完全清楚。本研究采用体外EV71感染和抗EV71病毒治疗模型,探讨AST-IV抗EV71病毒的作用机制。
1. AST-IV抑制EV71复制
为研究AST-IV对EV71复制的影响,研究者利用AST-IV处理GSE-1细胞,再用EV71感染,结果表明AST-IV对细胞活力无影响,但提高了被EV71感染的细胞活力(图1B-C)。此外,AST-IV处理降低了EV71感染的GES-1细胞的VP1蛋白水平和病毒滴度(图1D-F),这表明病毒复制降低。综上所述,AST-IV能有效抑制EV71的复制。
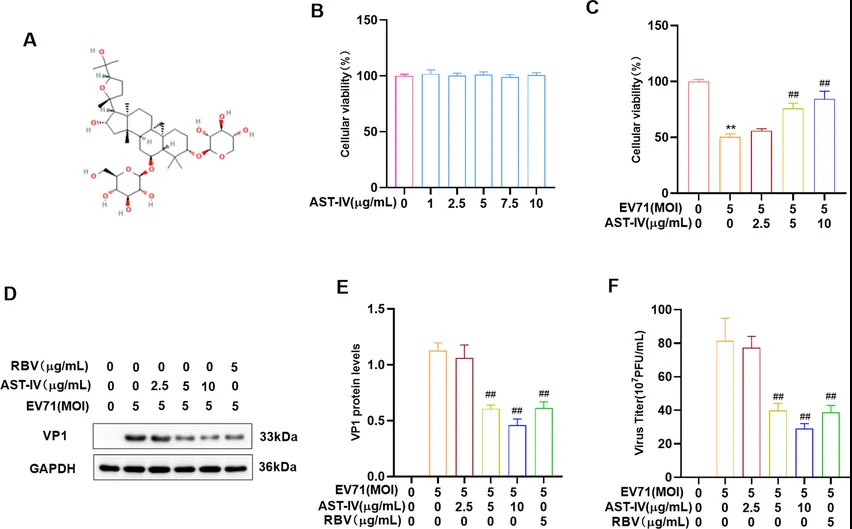
图1. AST-IV抑制EV71复制
2. AST-IV对EV71诱导细胞凋亡的影响
采用碘化甲基(propyl iodide, PI)染色和免疫印迹法(Western blot, WB)研究AST-IV对EV71诱导的细胞凋亡的保护作用。结果表明,EV71感染显著增加了PI阳性细胞的数量,但AST-IV治疗降低了阳性细胞数量,这表明AST-IV对EV71诱导的细胞毒性具有保护作用(图2A-B)。此外,裂解的PARP和caspase-3水平在EV71感染的GES-1细胞中显著增加,而AST-IV抑制了PARP和caspase-3蛋白的降解,这表明EV71感染激活细胞凋亡,AST-IV对EV71诱导的细胞凋亡具有保护作用(图2C-E)。综上所述,AST-IV对EV71诱导的GES-1细胞凋亡具有保护作用。
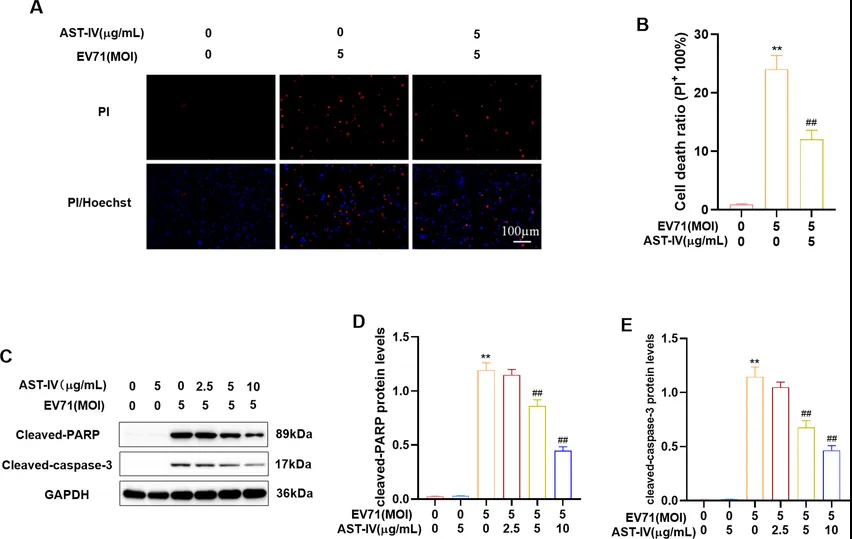
图2. AST-IV对EV71诱导细胞凋亡的影响
3. EV71感染和AST-IV处理的GES-1细胞代谢谱分析
作者利用代谢组学研究AST-IV是如何通过调节代谢物来发挥其对抗EV71病毒的复制机制。首先PCA和OPLS-DA显示对照组、EV71组、AST-IV组和EV71_AST-IV组的样本明显分离(图3)。火山图显示对照组与EV71组、对照组与AST-IV组和EV71组与AST-IV分别有293、196和302个差异代谢物(图4A-C)。韦恩图显示三组共有114种差异代谢物(图4D)。其中次黄嘌呤、2-酮丁酸、腺嘌呤等8种代谢物在AST-IV处理的GES-1细胞中显著改变(图5A-H)。经AST-IV处理后,这些代谢物在感染EV71的细胞中发生回调(代谢物的水平恢复到与对照组基本相同的水平)。AST-IV对核苷酸代谢、细胞能量产生和柠檬酸循环、细胞生长激素代谢、脂肪酸代谢、磷脂代谢有影响。综上所述,这些代谢物可能作为AST-IV抑制EV71感染的潜在靶点。
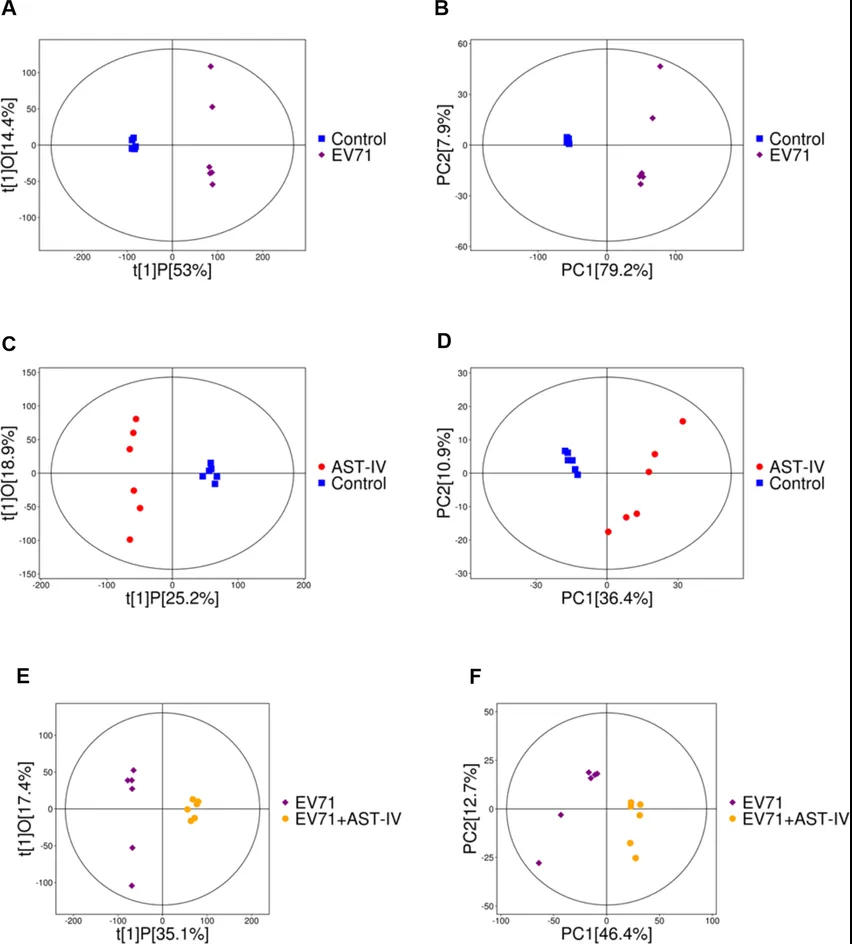
图3. PCA和OPLS-DA模型得分图
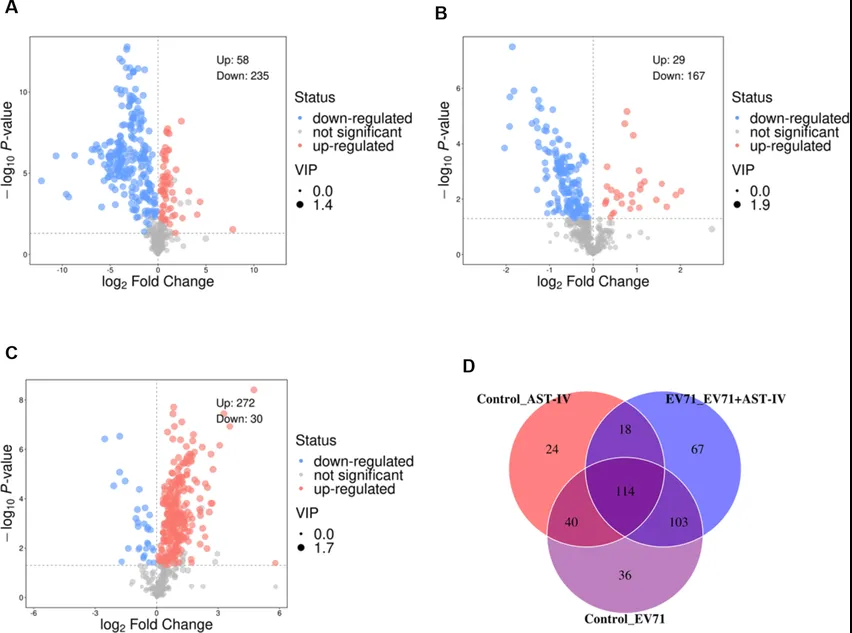
图4. 火山图和韦恩图分析四组不同代谢产物
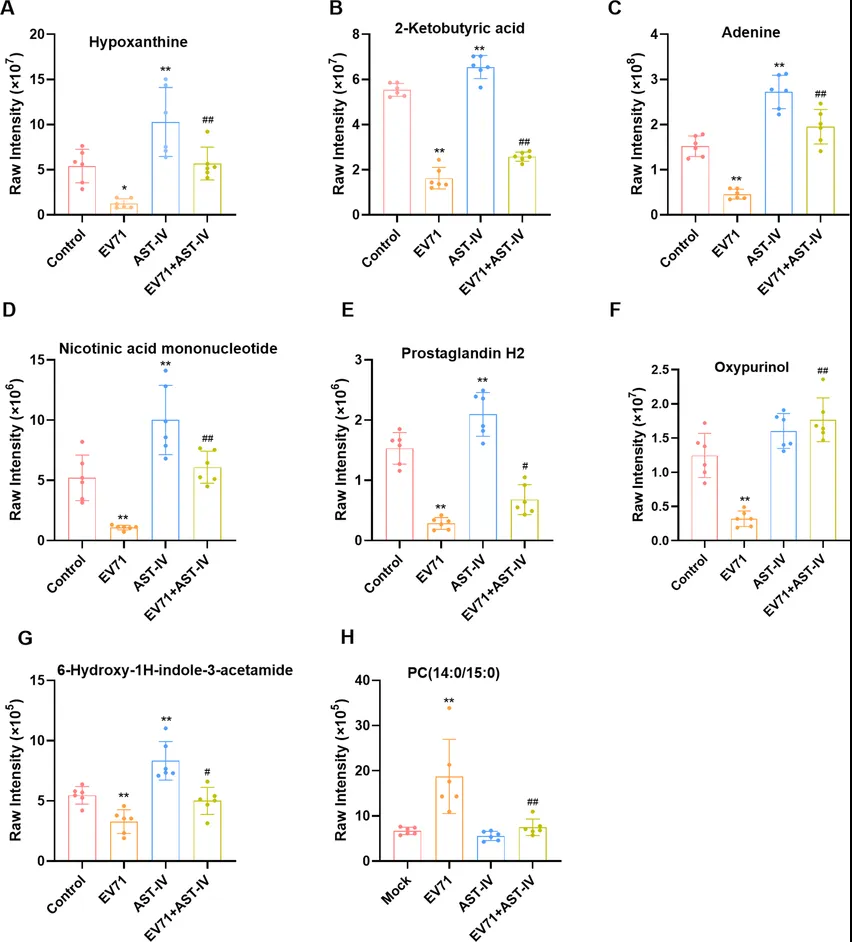
图5. AST-IV调节的与EV71感染相关的GES-1细胞指标的相对峰值区域
4. AST-IV对抗氧化活性的影响
为了研究氧化应激与病毒复制之间的关系,作者检测了活性氧(reactive oxygen species, ROS)水平和氧化应激生物标志物。结果显示AST-IV处理降低了EV71感染的GES-1细胞或RD细胞的ROS水平,增加了过氧化氢酶(catalase, CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)和总抗氧化能力(total antioxidant capacity, T-AOC)的活性,同时降低了丙二醛(malondialdehyde, MDA)水平(图6A-G)。结果表明,AST-IV可有效保护GES-1细胞和RD细胞免受EV71诱导的氧化损伤。同时,研究者发现ROS抑制剂-乙酰半胱氨酸(N-Acetylcysteine, NAC)降低了EV71感染的GES-1细胞上清液中的VP1蛋白水平和病毒滴度(图6H-J),这表明AST-IV和NAC都可能通过减少氧化应激来抑制EV71的复制。因此AST-IV通过抑制EV71诱导的氧化应激发挥抗EV71的作用。
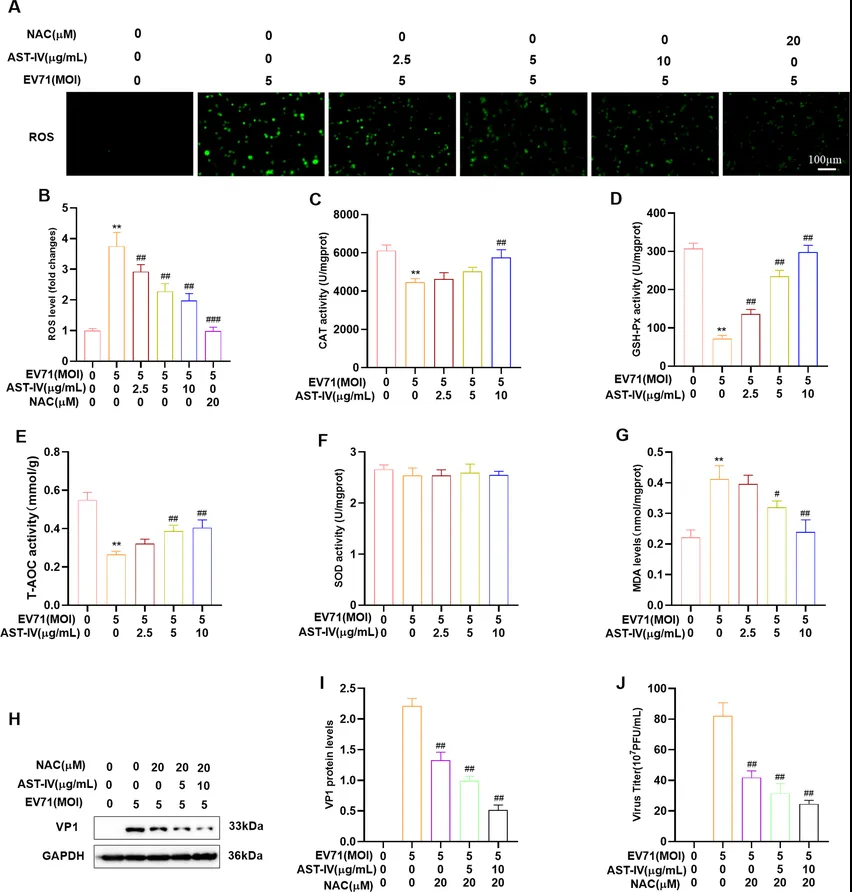
图6. AST-IV对抗氧化活性的影响
5. AST-IV和手足口病的靶点
利用网络药理学分析来探讨AST-IV治疗手足口病的机制。从OMIM数据库、DisGenet数据库和GeneCards数据库分别收集了535个、63个、1470个靶点。同时根据高通量基因表达数据库(Gene Expression Omnibus, GEO)中RNA序列(GSE15323)筛选了312个差异基因(Differential Expression Analysis, DEGs),最终鉴定出2223个与手足口病相关的治疗靶点(图7A)。同时收集了AST-IV的100个治疗靶点(来自Swiss TargetPrediction database和TargetNet数据库)(图7B)。AST-IV和手足口病有44个共同靶点(图7D)。
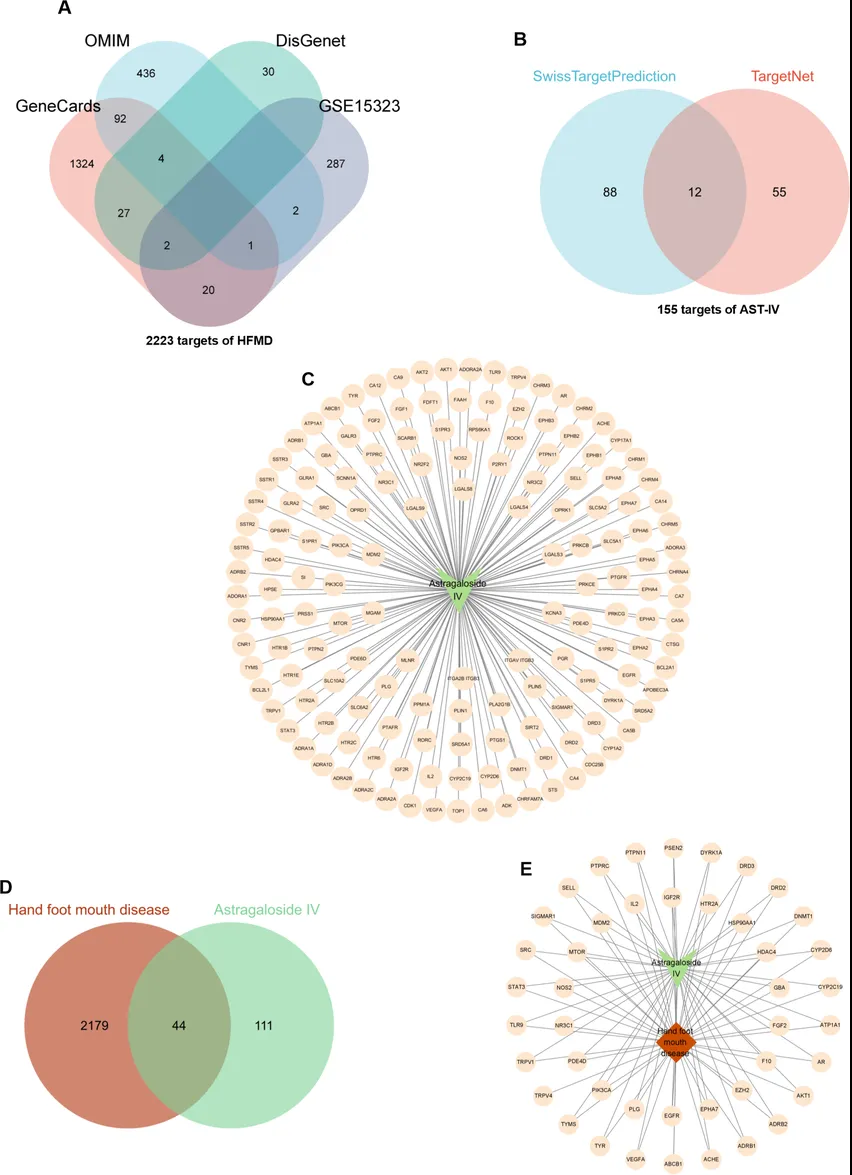
图7. AST-IV和手足口病的靶点
6. 网络构建与分析
利用Cytoscape构建44个共同靶点的PPI网络,根据度值排名筛选前10位的枢纽基因,同时使用cytoHubba插件筛选了排名前10位的枢纽基因。最终鉴定了6个常见的枢纽基因(图8A-B),分别是AKT1、SRC、STAT3、EGFR、HSP90AA1和MDM2,并构建了PPI网络(图8C)。GO富集表明AST-IV对EV71复制的抑制与药物应答、细胞对外部刺激的应答、脂质代谢过程的调节、活性氧生物合成过程的调节等有关(图8D)。KEGG富集分析显示,枢纽基因主要富集于PI3K- AKT信号通路、cAMP信号通路以及脂质和动脉粥样硬化信号通路(图8E)。使用metscape进行KEGG分析,关键靶点与PI3K-AKT通路密切相关(图8F)。
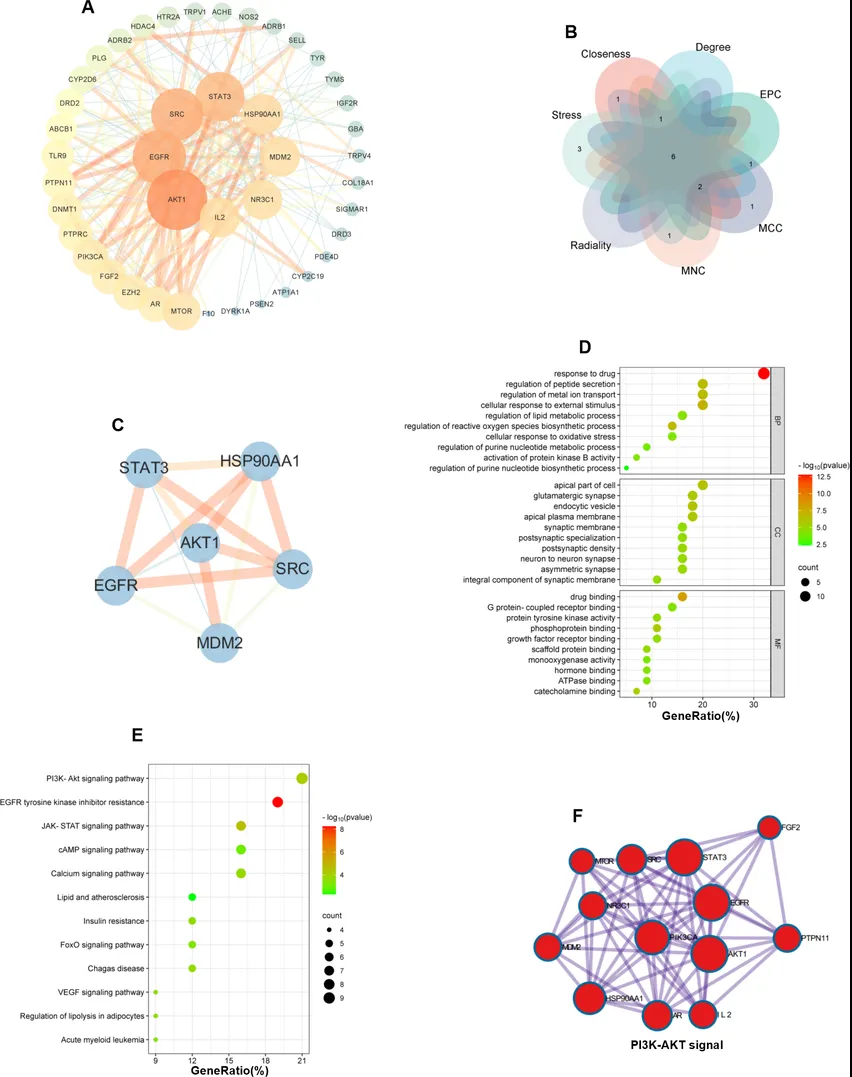
图8. 网络构建与分析
7. AST-IV对EV71感染GES-1细胞中PI3K-AKT通路的影响
利用WB和分子对接技术研究AST-IV对EV71感染GSE-1细胞中PI3K-AKT通路的影响。作者发现EV71感染组的p-PI3K和p-AKT水平呈剂量依赖性降低,而AST-IV处理组的p-PI3K和p-AKT水平升高,同时AST-IV 治疗逆转了对 PI3K-AKT信号通路的抑制作用(图9A-I),这表明AST-IV抵消了EV71对GES-1细胞中PI3K-AKT通路的负面影响。分子对接法表明AST-IV与AKT1和PIK3R1蛋白之间有良好的键合。综上所述,AST-IV治疗可激活PI3K-AKT通路,并逆转EV71感染对GES-1细胞的抑制作用。
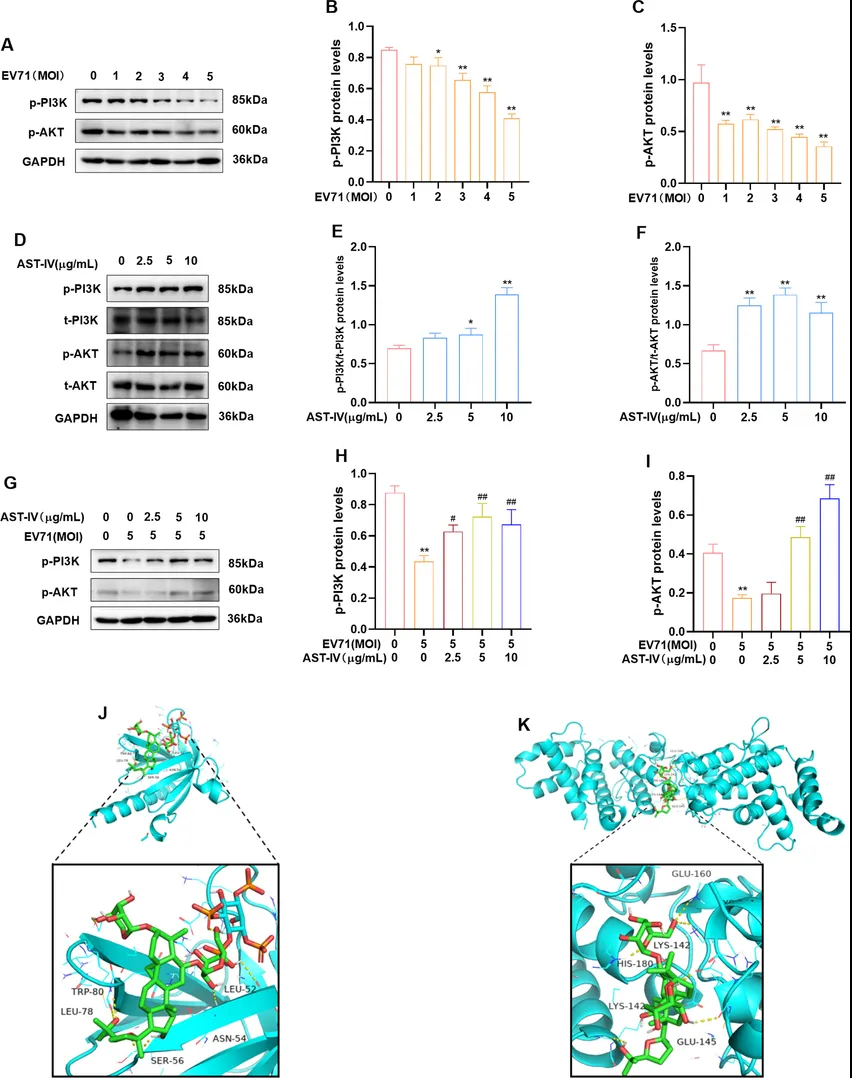
图9. AST-IV对EV71感染和AST-IV处理的GES-1细胞PI3K-AKT通路的影响
8. 代谢物与表观指标之间的关系
采用相关性分析探讨代谢物对氧化应激、PI3K-AKT信号传导、细胞凋亡和EV71病毒复制的影响(图10),发现次黄嘌呤、2-酮丁酸、烟酸单核苷酸、前列腺素H2等与ROS、MDA、细胞凋亡和VP1蛋白水平呈负相关,与PI3K-AKT信号通路、T-AOC、GSH-Px、CAT呈正相关。综上所述,AST-IV可能通过与次黄嘌呤、2-酮丁酸等8种关键代谢物相互作用,促进PI3K-AKT信号传导,从而抑制EV71的复制,最终引发抗氧化应激反应。
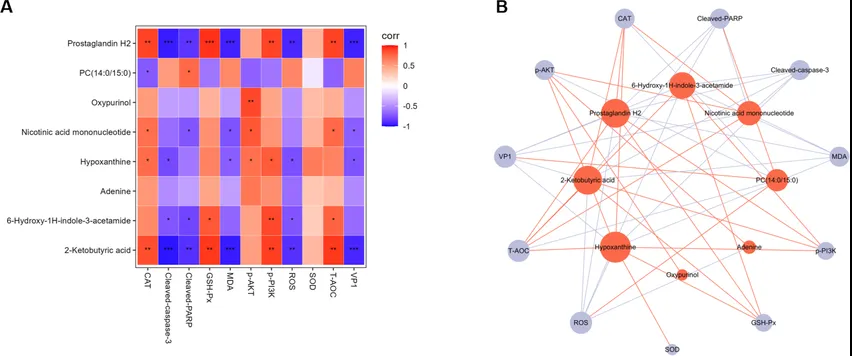
图10. 目标代谢物与表观指标的相关性
通过组学研究和验证实验,作者发现AST-IV可通过次黄嘌呤、2-酮丁酸和腺嘌呤等8种代谢物激活cAMP和抗氧化应激反应,进一步刺激PI3K-AKT信号传导,从而抑制EV71诱导的细胞凋亡和 EV71复制。接下来,作者将确定AST-IV与PI3K和AKT的靶向结合位点,并在动物模型和临床试验中验证这些发现,以此来评估AST-IV治疗EV71感染的转化潜力,为治疗手足口病提供一种可能的治疗方案。