
英文标题:Tianma Gouteng Decoction improve neuronal synaptic plasticity and oligodendrocyte apoptosis in Parkinson’s disease mice
中文标题:天麻钩藤饮可改善帕金森病小鼠模型中的神经元突触可塑性与少突胶质细胞凋亡
发表期刊:Phytomedicine
影响因子:8.3
研究背景
帕金森病(Parkinson’s disease, PD)是一种复杂的多因素神经系统疾病,其核心特征是患者黑质纹状体区多巴胺能神经元的进行性丢失。临床表现为静止性震颤、运动迟缓、肌强直以及姿势步态障碍等运动症状。尽管现有治疗主要依赖多巴胺替代疗法(如左旋多巴)和手术干预,但药物疗效随病程进展逐渐减弱,且无法阻止神经元变性及疾病恶化。值得注意的是,尽管路易体在PD患者脑中普遍存在,但其是否为直接病因仍存争议。在此背景下,传统中医(Traditional Chinese Medicine)因其多成分、多靶点的特性,为PD治疗提供了新的研究方向。例如,天麻钩藤饮(Tianma Gouteng Decoction, TGD)作为经典的中医复方,已被证实可改善PD患者的运动障碍及动物模型的神经损伤,并与多巴胺替代药物(如左旋多巴)联用时能增强疗效。然而,TGD中潜在的活性成分及其作用靶细胞仍需深入解析。为此,本研究结合多组学分析与单细胞测序技术,旨在揭示TGD治疗PD的分子机制。
研究结果
2.1 TGD修复了多巴胺能神经元并改善了PD小鼠的运动障碍
首先,TGD对MPTP诱导的PD小鼠的治疗效果被探索。结果表明,TGD治疗(3周,3种剂量)显著逆转了MPTP诱导的运动功能损伤(图1A-D),具体表现为:旋转柱停留时间延长、悬尾评分提升、杆上下降时间缩短。此外,通过黑质致密部免疫荧光分析发现(图1E-F),TH+多巴胺能神经元损伤显著恢复;α-突触核蛋白(α-syn)异常表达被显著抑制。综上,TGD不仅能缓解PD小鼠的运动障碍,还可通过修复多巴胺能神经元和调控关键病理蛋白(α-syn),发挥潜在的神经保护作用。
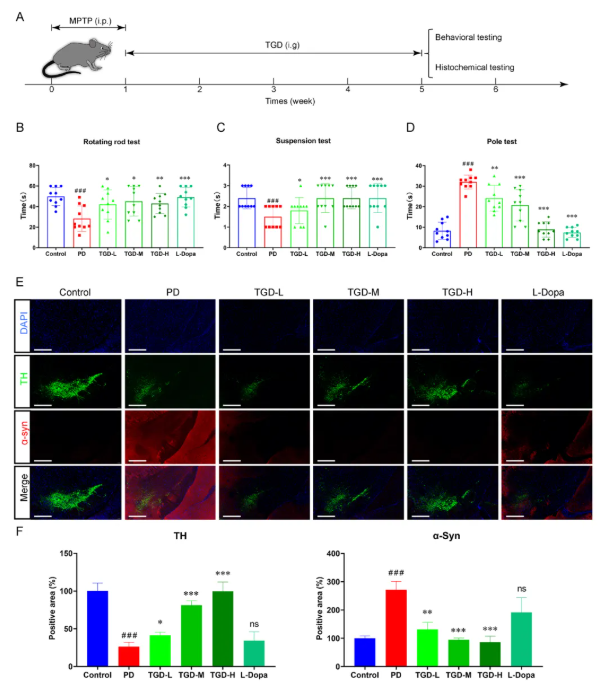
图1 TGD对帕金森病小鼠运动障碍及病理特征的影响
2.2 PG小鼠TGD水提物及血清成分分析
在明确了TGD对PD小鼠的显著治疗效果后,接着采用UPLC-Q-Orbitrap HRMS,对TGD成分进一步分析(图2)。结果显示,TGD水提取物成分极其复杂,共检测到1272种化学成分,涵盖了酚酸类、黄酮类、生物碱类等八大类物质(表2)。另外,在PD小鼠口服TGD后的血清样本中,总计73种成分能够进入体循环而被鉴定(表3),其类别与水提取物中的主要成分相对应,但数量大幅减少,暗示着中药在体内吸收和代谢的过程。
图2 UPLC-Q-Orbitrap HRMS正、负离子模式总离子色谱图
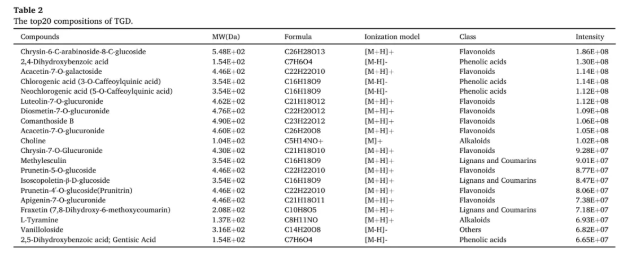
表2 TGD排名前20位的成分
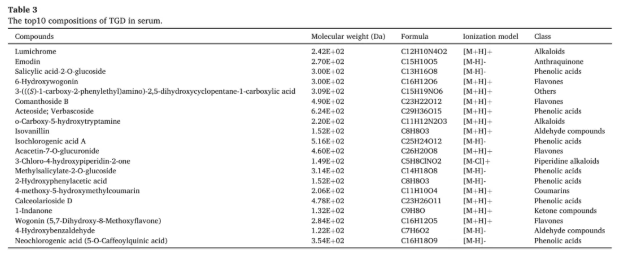
表3 血清中TGD的TOP10成分
2.3 PD类化合物的药理靶点分析
为阐明TGD的药理机制,通过生物信息学技术,其作用靶点被率先挖掘。首先,从三大数据库(SwissTargetPrediction、SuperPred和BATMAN-TCM)挖掘出1125个潜在靶点(图3A),随后结合PD相关数据库(DisGeNET、OpenTargets、GeneCards),通过交集分析鉴定出135个核心靶点(图3B)。其次,通过Network Analyzer分析网络拓扑结构,筛选出前20个主要成分(图3C),同时“化合物-靶点-疾病网络”也揭示出67种活性成分与135个PD靶点的复杂关联(图3D)。最后,透过靶点功能富集与通路解析,发现核心靶点(如TP53、AKT1、CASP3、IL1B、TNF-α和IL6)主要参与炎症反应与细胞凋亡的调控(图3E)。它们在生物过程中主要涉及细胞凋亡的负调控、细胞增殖的正调控;在分子功能上关联酶结合、受体结合等;在细胞组分上富集于线粒体、蛋白复合物等(图3F)。此外,在168条信号通路中,凋亡、活性氧代谢、PI3K-Akt和VEGF信号通路是关键调控路径(图3G)。综上,TGD化合物在PD中具有广泛的药理靶点,参与凋亡和炎症的调控。
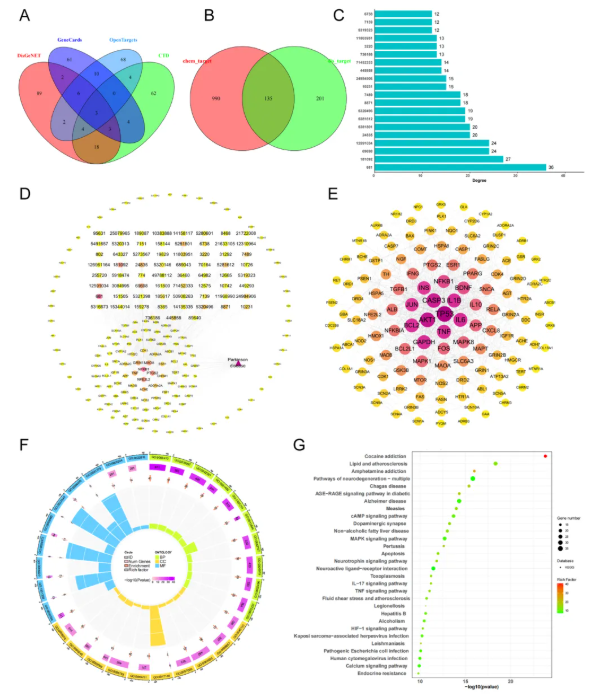
图3 PG小鼠TGD血清成分的靶点预测与分析
2.4 TGD靶细胞调控的单核RNA测序分析
为更深入地识别TGD在PD治疗中的作用靶点,运用单细胞核RNA测序(snRNA-seq)技术,不同细胞亚型对TGD治疗的响应差异被深入分析。结果显示:①总计11,056个高质量细胞被鉴定,经PCA降维与UMAP可视化后,发现TGD治疗与PD组均包含23个可分类细胞簇,对应18种细胞类型(如神经元、小胶质细胞、少突胶质细胞等)(图4A-C)。②神经元、星形胶质细胞和少突胶质细胞是TGD治疗中响应最显著的三类细胞(图4D)。在这三类细胞中,神经元中的Lrrm4和DPP10、星形胶质细胞中的Gpc5和Stc1a2、少突胶质细胞中的Plp1和Fth1等基因存在显著差异表达(图4E)。③拟时序分析显示,神经元首先响应TGD治疗,随后与少突胶质细胞的交流显著增强(图4F)。④在PD体外细胞模型中,qPCR验证了上述基因的表达变化:TGD治疗可剂量依赖性地逆转MPP+诱导的Lrrm4、DPP10、Gpc5、Stc1a2、Plp1和Fth1下调(图4G-L)。
此外,神经元中差异表达基因的富集分析显示,其在细胞组分中富集于谷氨酸能突触、轴突、突触后膜等结构;在KEGG信号通路中涉及轴突导向、钙信号、谷氨酸能/胆碱能/GABA能突触等(图5A-B)。这些结果进一步强调了突触可塑性在TGD治疗响应中的核心地位。
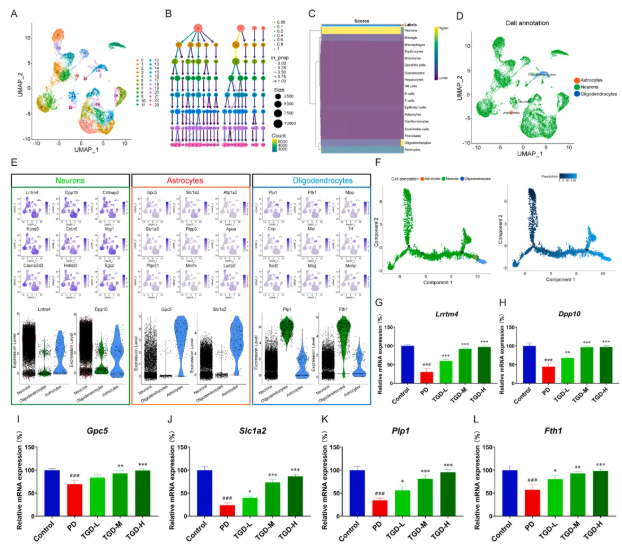
图4 SnRNA-seq分析TGD对PG小鼠全脑组织的影响
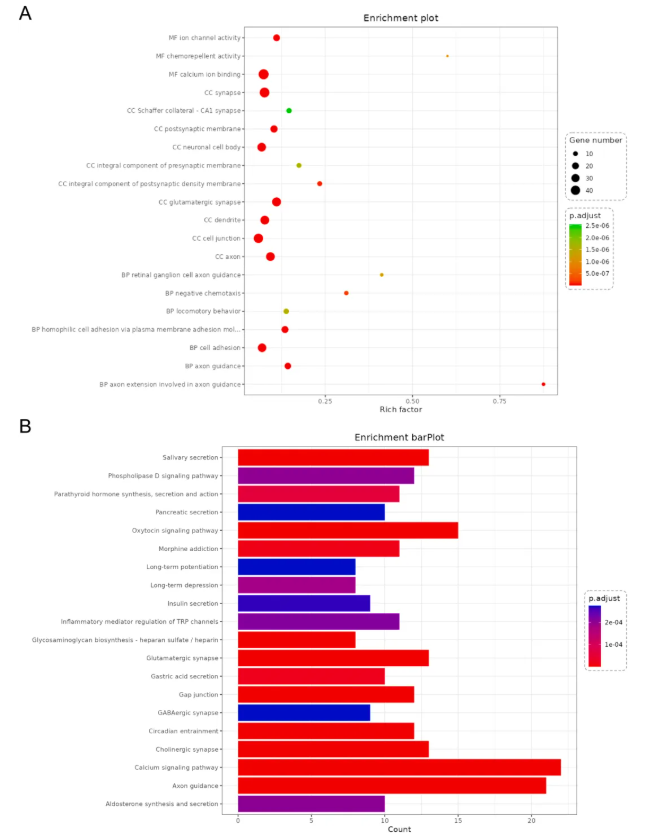
图5 神经元差异表达基因的生物信息学分析
2.5 对可穿透血脑屏障的化合物及其作用靶点进行网络药理学分析
为揭示TGD活性成分穿透血脑屏障(BBB)的能力及其在PD病理调控中的核心靶点,网络药理学被用于进一步分析。首先,通过BBB穿透性分析,TGD中的15种活性成分可进入大脑(表4),并且这些成分的靶点(如MAOB、MAOA、CASP3、NFE2L2等)与PD病理密切相关(图6A),其中,MAPK10(DUSP16)、MAPK9、MAPK8、CASP3和NFE2L2是凋亡调控的关键节点,同时又与PD病理靶点(如3-甲基水杨酸、阿魏酸异戊酯等)存在强相互作用(图6B-C)。其次,通过分子对接验证,这些活性成分与PD病理靶点的结合关系被进一步揭示(图6D,表5),结合RMSD分析,发现NFE2L2–阿魏酸复合体系的RMSD值最低,表明阿魏酸小分子与NFE2L2靶蛋白结合时表现出高稳定性(图6E-G)。最后,这些复合体系在运动过程中,旋转半径(Rg)和溶剂可及表面积(SASA)均保持稳定波动,表明靶蛋白-小分子复合物在模拟过程中始终稳定且紧凑(图6E-G)。
此外,氢键在配体与蛋白结合中也起着重要作用。在动态模拟过程中,各复合体系的氢键数量动态稳定,也进一步验证了活性成分与靶蛋白结合的可靠性(图6H)。
综上,TGD通过其活性成分穿透血脑屏障后,可靶向调控凋亡相关通路(如MAPK和CASP3),这为中药复方治疗PD的神经保护作用提供了关键的分子依据。
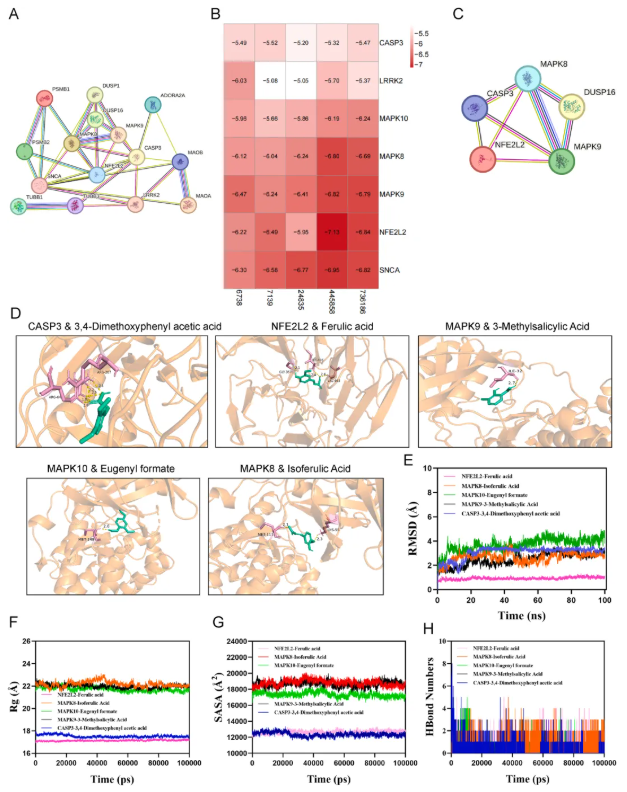
图6 神经元TGD活性成分与潜在靶点的联合分析
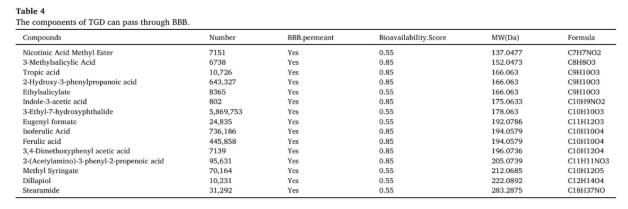
表4 TGD的成分可以通过BBB
2.6 TGD治疗改善了PD中的神经元-少突胶质细胞交流
上述snRNA-seq结果强调了TGD对PD突触的潜在影响,结合免疫荧光(图7A-C)和ELISA分析(图7F-G),进一步表明TGD能够显著缓解了纹状体中TH神经元的突触损伤,并上调了突触可塑性标志物PSD95,同时也有效改善了PD小鼠的多巴胺(DA)和5-羟色胺(5-HT)的分泌。在体外实验中,TGD更是提高了诱导模型的存活率,并抑制了神经元损伤(图7D-E)。因此,TGD能够有效改善PD中神经元的突触可塑性。
此外,在snRNA-seq分析中,少突胶质细胞差异表达基因的KEGG通路也涉及着凋亡调控,透过免疫荧光分析,发现PD组少突胶质细胞凋亡显著,但TGD治疗后其凋亡显著改善(图8A-C),这表明TGD有效抑制了PD中少突胶质细胞的凋亡。
当聚焦营养因子与炎症因子的调控时,TGD上调了中脑组织中营养因子BDNF和NGF的表达(图9A-B)。此外,少突胶质细胞也参与炎症反应,其中,TGD不仅有效改善了少突胶质细胞源性炎症因子CCL2的表达(图9C),而且也显著下调神经炎症关键因子IL-1β、IL-6和TNF-α(图9D-F)。总的来说,TGD治疗不仅恢复了少突胶质细胞功能,还抑制了神经炎症。
综上,TGD治疗PD的关键是少突胶质细胞功能的恢复,其活性成分穿透血脑屏障后,通过减少少突胶质细胞凋亡、增强营养因子表达、恢复神经元突触可塑性并抑制神经炎症(图10)。
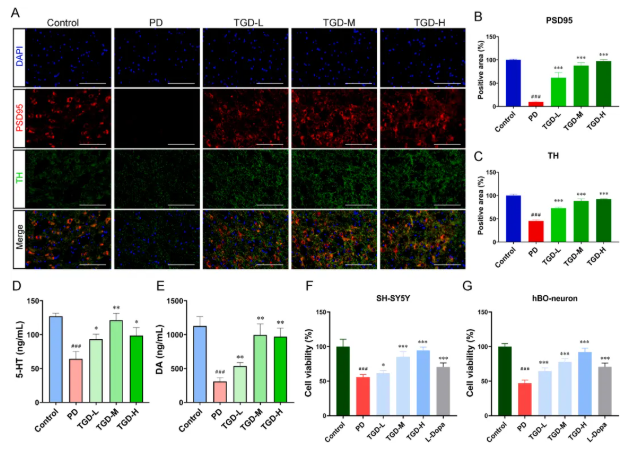
图7 TGD对神经元突触可塑性的影响
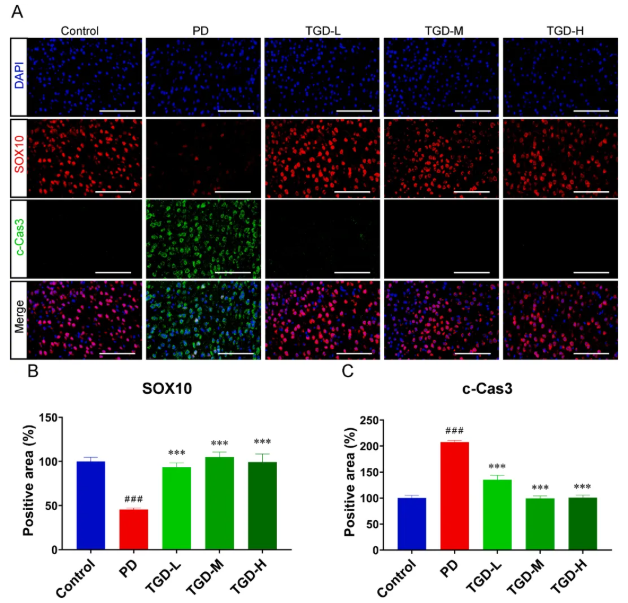
图8 TGD对少突胶质细胞凋亡的影响
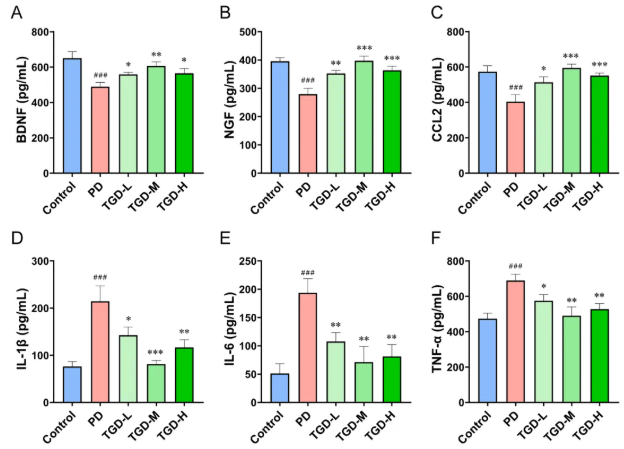
图9 TGD治疗对营养因子表达和炎症反应的ELISA分析
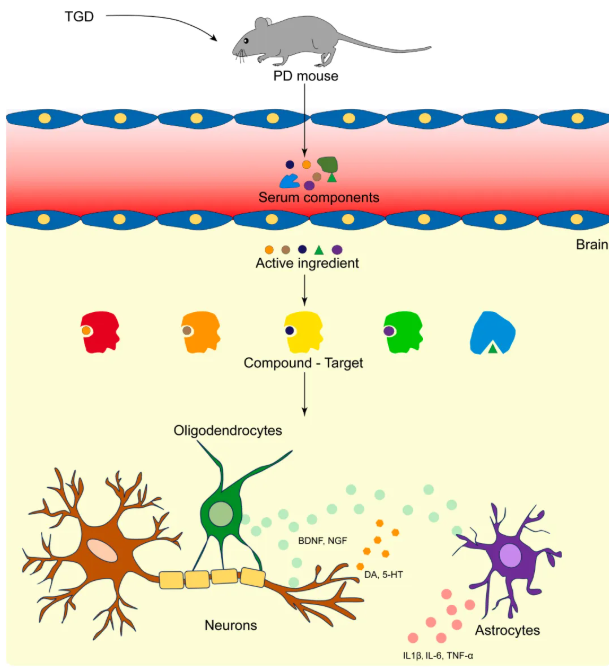
图10 TGD治疗帕金森病具有多成分、多靶点的脑保护机制
研究结论
本研究系统性地阐明了TGD治疗帕金森病的分子机制,揭示其多维度的作用靶点和通路。主要内容如下:首先,从TGD鉴定出的物质中,总计73种成分被鉴定存在于PD小鼠血清中,并且参与了细胞凋亡的调控,而其中就有15种能够穿透血脑屏障。其次,借由snRNA-seq,揭示出神经元是TGD最广泛的响应细胞,而少突胶质细胞是其治疗的核心靶细胞。最后,TGD实现治疗效果的分子机制被验证,其关键环节为恢复“神经元-少突胶质细胞交流”,具体表现为:抑制少突胶质细胞的凋亡,增强营养因子的分泌,从而促进神经元突触可塑性的改善和神经炎症的抑制。综上所述,这项研究系统地阐明了TGD治疗帕金森病的分子机制,并为TGD治疗帕金森病提供了坚实的分子机制证据。
DIA中药入血组:百趣生物创新性地运用DIA数据采集模式采集血清中的中药药物成分,从数据采集上避免入血/入组织药物信息的遗漏,尽可能全面采集进入血液和组织的中药药物成分。并通过检索百趣生物自建中药标准品数据库和中药专属数据库,对血液样本或组织样本中的药效成分进行准确鉴定,同时结合药物成分在体内的代谢变化,并通过深入的分析内容呈现中药治疗疾病的作用机制。