
英文标题:High mobility group A1 (HMGA1) promotes the tumorigenesis of colorectal cancer by increasing lipid synthesis
中文标题:高迁移率族蛋白A1(HMGA1)通过增加脂质合成促进结直肠癌的肿瘤发生
发表期刊:nature communications
影响因子:15.7
客户单位:河南大学
百趣提供服务:非靶标代谢流
研究背景
代谢重新编程是癌症的标志,使肿瘤细胞能够满足其增殖所需的高能量和生物合成需求。高迁移率族蛋白A1(HMGA1)是一种结构转录因子,在人类结直肠癌(CRC)中经常过度表达。在这里,我们表明HMGA1通过在AOM/DSS诱导的CRC小鼠模型中驱动脂质合成来促进CRC的进展。使用条件敲除(Hmga1△IEC)和敲入(Hmga1IEC-OE/+)小鼠模型,证明了HMGA1通过上调脂肪酸合成酶(FASN)来增强CRC细胞增殖并加速肿瘤发展。从机械学上讲,HMGA1增加了FASN启动子上固醇调节元件结合蛋白1(SREBP1)的转录活性,导致肠道上皮细胞中的脂质积累增加。此外,高脂肪饮食加剧了Hmga1△IEC小鼠的CRC进展,而奥利司他对FASN的药理抑制会减少Hmga1IEC-OE/+小鼠的肿瘤生长。本研究表明,靶向脂质代谢可以为CRC提供一个有前途的治疗策略。
研究结果
2.1 HMGA1在结直肠癌组织中的高表达
为明确HMGA1在CRC中的表达情况,研究者首先利用GEPIA和GEO数据库分析发现,CRC组织中HMGA1 mRNA水平显著高于邻近正常组织(图1a-c)。进一步分析发现,HMGA1的表达在CRC发生发展过程中持续升高(图1d),且高表达患者的疾病特异性生存率显著下降(图1e)。在单细胞水平上,HMGA1在肠道上皮细胞(Intestinal Epithelial Cells, IECs),特别是Ki67⁺IECs中显著升高(图1f-g)。这些结果表明HMGA1和IEC增殖之间存在潜在的关联。此外,IHC染色表明,HMGA1在CRC患者的肿瘤组织中被上调(图1h-i)。
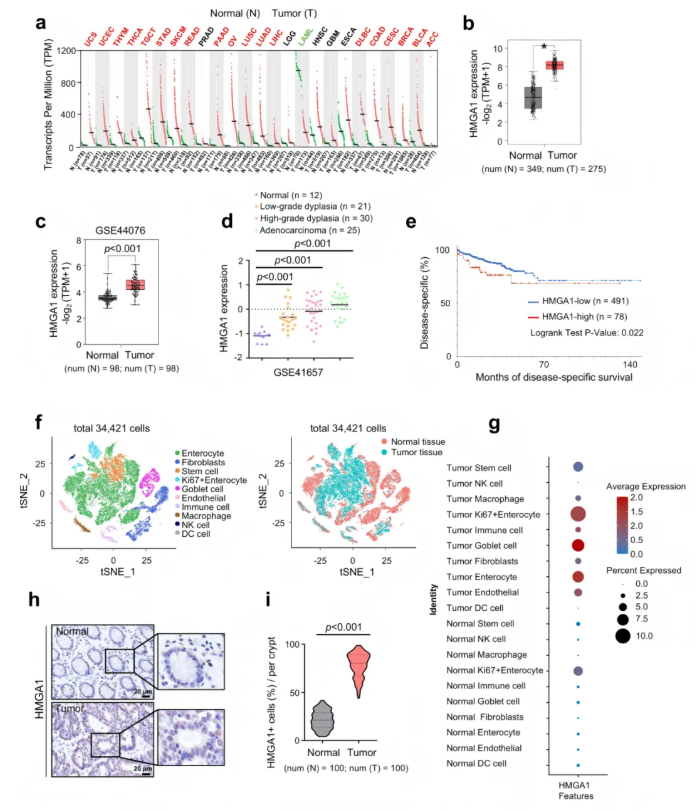
图1. HMGA1在结直肠癌中高表达
2.2 HMGA1促进结直肠癌的发生发展
在体外实验中,HMGA1过表达能够显著增强CRC细胞的生长、增殖和克隆形成能力,而敲低HMGA1则产生相反效果。基于这些发现,研究者进一步在体内验证HMGA1的作用。通过CRISPR-Cas9系统构建了小肠上皮细胞特异性HMGA1条件性敲除小鼠(Hmga1△IEC)和条件性过表达小鼠(Hmga1IEC-OE/+),并利用AOM/DSS诱导CRC(图2a)。结果显示,AOM/DSS诱导的Hmga1IEC-OE/+小鼠与Rosa26Hmga1/+(对照)小鼠相比,结肠直肠严重缩短,结肠中肿瘤数量和体积与显著增加,小鼠的存活率较低(图2b-e),Hmga1IEC-OE/+小鼠的肠道结构在光学显微镜下基本正常,然而,AOM/DSS诱导的Hmga1IEC-OE/+小鼠的结肠中,高级别异型增生(HGD)腺瘤和癌的比例大幅增加(图2f)。IHC染色显示,HMGA1的表达和Ki67阳性细胞的数量明显增加(图2g)。这些结果表明,HMGA1促进CRC细胞的恶性表型,并增强CRC肿瘤的生长。
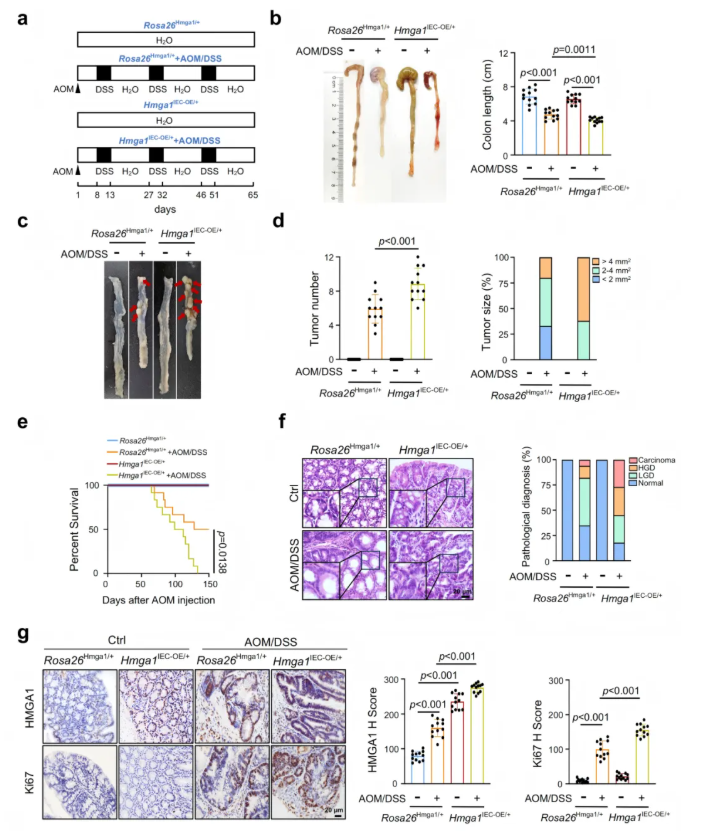
图2. HMGA1促进结直肠癌的发生发展
2.3 HMGA1缺失抑制CRC的发生发展
随后为了进一步验证HMGA1在CRC肿瘤发生中的作用,将Hmga1△IEC(敲除)小鼠和Hmga1flox/flox(敲除对照)小鼠暴露在AOM/DSS中,以诱导CRC,结果表明与敲除对照相比,Hmga1△IEC小鼠存活率提高,结肠直肠的肿瘤数量和大小显著减少。IHC染色显示,AOM/DSS诱导的Hmga1△IEC小鼠结肠直肠的Ki67阳性细胞减少。这些结果表明,HMGA1缺失显著抑制CRC的增殖和肿瘤形成(图3)。
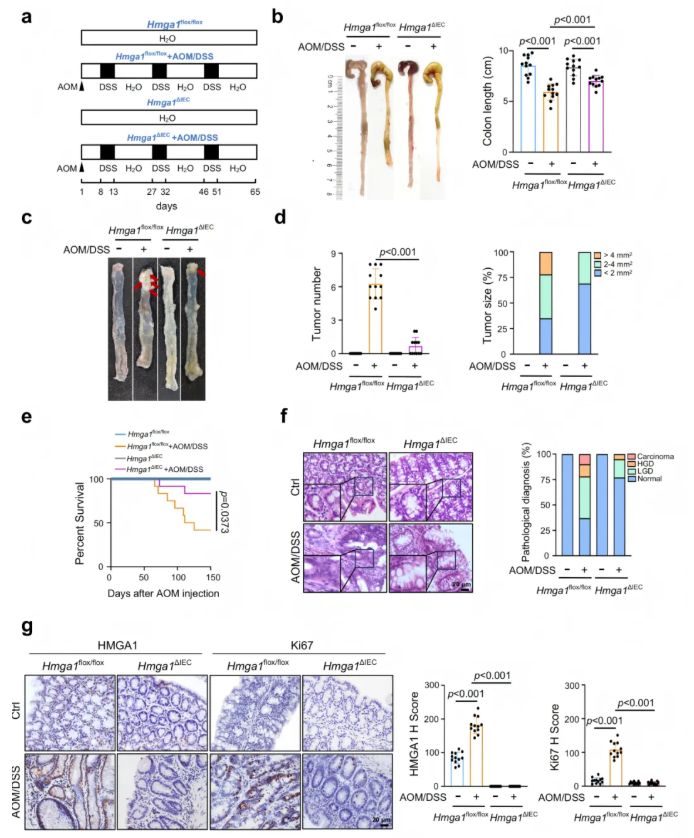
图3. HMGA1缺失抑制CRC的发生和发展
2.4 HMGA1促进脂质积累
为探索HMGA1是否通过调节脂质代谢促进CRC,研究者对Hmga1△IEC小鼠和Hmga1flox/flox小鼠的IECs进行了非靶代谢组学分析。结果显示,Hmga1△IEC小鼠IECs中120种代谢物下调,其中脂肪酸及其衍生物显著减少(图4a-b),而 Hmga1IEC-OE/+小鼠肿瘤组织中脂肪酸及游离脂肪酸显著上调。表明,HMGA1的表达与脂肪酸合成的激活之间存在正相关。在体外实验中,HMGA1过表达的CRC细胞显示油红O和Nile Red染色信号增强,甘油三酯(TG)、总胆固醇(TC)和游离脂肪酸(FFA)水平升高(图4c-e)。相反,HMGA1敲低细胞的脂质含量明显下降。在小鼠模型中,Hmga1IEC-OE/+小鼠结肠组织中脂滴数量和总脂质显著增加,而 Hmga1△IEC小鼠IECs的脂质积累明显减弱(图4f-g)。为了进一步确定HMGA1在de novo脂肪生成中的作用,使用13C标记葡萄糖追踪实验,HMGA1过表达细胞中新合成的饱和脂肪酸和单不饱和脂肪酸显著增加,而HMGA1敲低细胞中新合成脂肪酸减少(图4h)。
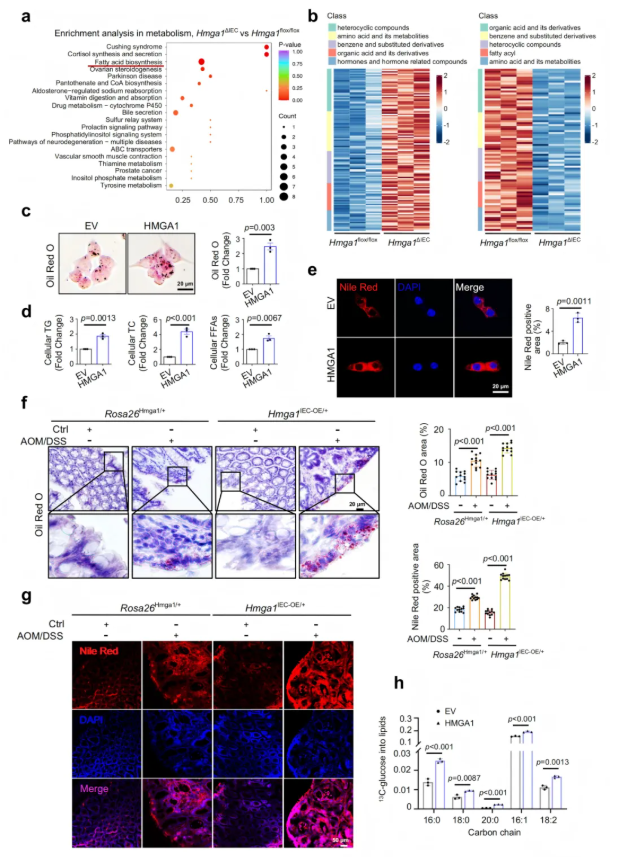
图4. HMGA1促进脂质积累
2.5 HMGA1上调FASN促进脂肪酸合成
为探索HMGA1促进脂质积累的机制,研究者在HT-29细胞中进行HMGA1敲低RNA-seq分析,结果显示HMGA1缺失显著下调脂肪酸合成相关基因,包括 FASN、ACLY和ACC1,但对脂肪酸β-氧化相关基因如ACSL4、ACOX1和CPT1A无明显影响(图5a-b)。进一步的13C-葡萄糖示踪实验显示,HMGA1 过表达细胞中新合成脂肪酸增加,而FASN抑制剂 orlistat能显著阻断该过程(图5c),qPCR与Western blot验证显示,HMGA1过表达可显著上调FASN蛋白水平,而敲出HMGA1则降低FASN表达(图5d)。提示FASN是HMGA1诱导de novo脂肪酸合成的关键介导分子。在人类CRC样本和小鼠模型中进一步验证得到,HMGA1的表达水平与FASN呈正相关,HMGA1过表达显著上调FASN,而HMGA1缺失则降低FASN表达。
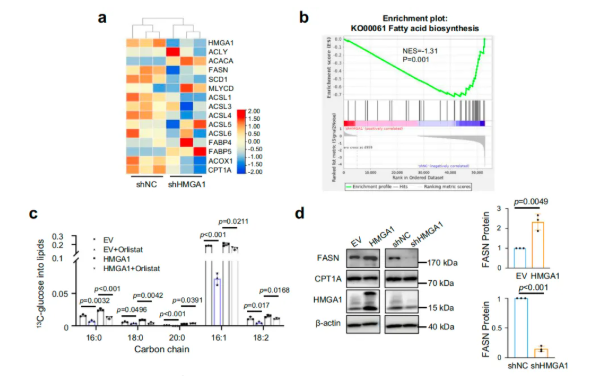
图5. HMGA1上调CRC中的FASN
2.6 FASN在HMGA1促进脂质积累中起中介作用
在CRC细胞中,敲出HMGA1会显著降低细胞内中性脂质及TG、TC和FFA水平。将FASN转导入HMGA1敲低细胞后,这些脂质水平得到恢复,说明FASN能逆转HMGA1缺失引起的脂质下降。相反,敲出FASN或使用FASN抑制剂orlistat均能阻断HMGA1 过表达诱导的脂质积累和TG、TC、FFA水平升高。综上,FASN是HMGA1诱导CRC细胞脂质积累的关键介导分子。
2.7 HMGA1通过增强SREBP1活性促进FASN转录
为探究HMGA1调控FASN的机制,研究者首先假设HMGA1可能通过增强FASN转录促进脂质积累。ATAC-seq结果显示,HMGA1敲低降低FASN启动子区域染色质开放性,HMGA1过表达则增强开放性,提示其可影响转录因子结合(图6b)。利用FASN启动子荧光素酶报告系统,发现HMGA1敲低显著降低FASN启动子活性,过表达则增强活性(图6c-d)。进一步分析发现,HMGA1可与转录因子SREBP1直接结合并在细胞核共定位(图6g-h),功能实验显示SREBP1过表达可恢复HMGA1敲低导致的启动子活性下降,而敲低SREBP1则抑制HMGA1对FASN的调控(图6i-j)。通过对FASN启动子不同片段及SREBP1结合位点突变分析,确定关键位点为R2(−67~−48 bp),ChIP实验证实HMGA1可促进 SREBP1 在该位点结合(图6l-n)。此外,HMGA1 的AT-hook II结构域(53–62 aa) 对FASN启动子活性必不可少。因此,得出结论,HMGA1通过其AT-hook II结构域促进FASN的转录激活。
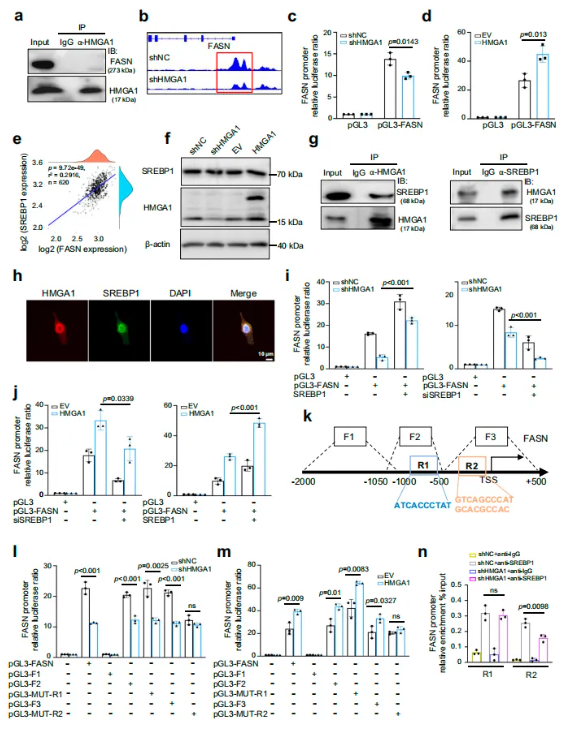
图6. HMGA1通过增强SREBP1活性促进FASN转录
2.8 高脂饮食消除Hmga1△IEC小鼠因HMGA1缺失产生的CRC肿瘤发生保护作用
为了验证脂质合成在HMGA1介导的CRC肿瘤发生中的作用,研究者对Hmga1flox/flox(对照)和Hmga1△IEC小鼠饲喂高脂饮食(HFD),并用AOM/DSS诱导CRC。结果显示,HFD加剧了肿瘤发生,降低了对照小鼠存活率,并增加肿瘤数量和体积;在Hmga1△IEC小鼠中,HFD同样显著提升了肿瘤组织中Ki67阳性细胞比例(图7)。该结果表明,高脂饮食可以消除HMGA1缺失对CRC的保护作用,进一步支持脂质供应在HMGA1促进CRC中的关键作用。
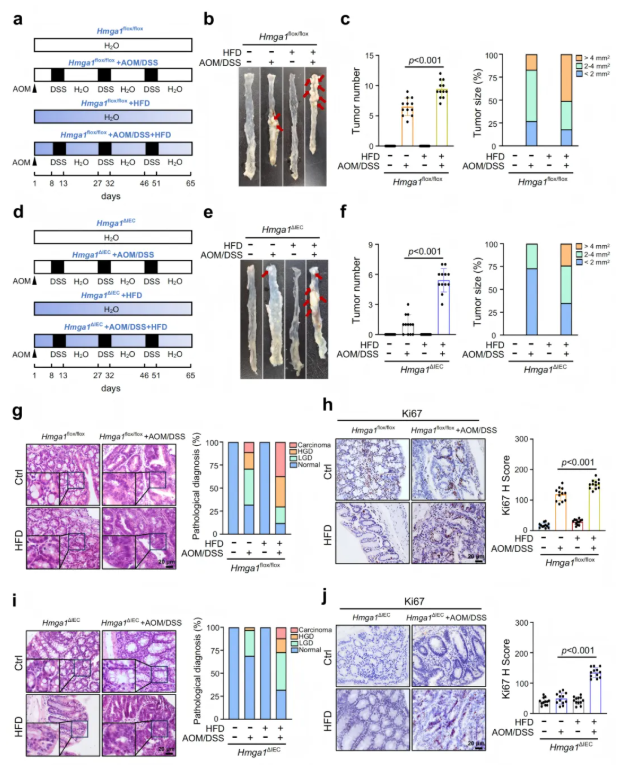
图7. HFD消除了Hmga1△IEC小鼠中HMGA1缺失对CRC肿瘤发生的保护作用
2.9 抑制FASN介导的脂质合成废除了HMGA1促进的CRC肿瘤发生
为了验证FASN在HMGA1促进CRC中的关键作用,研究者在AOM/DSS诱导的Hmga1IEC-OE/+和Rosa26Hmga1/+中,通过灌胃FASN抑制剂orlistat(50 mg/kg,每隔一天)进行干预。结果显示,orlistat显著延长Hmga1IEC-OE/+小鼠存活率,降低肿瘤数量和体积,减少LGD、HGD和腺癌比例,同时降低肿瘤中Ki67阳性细胞比例;对对照小鼠也同样有效(图8)。该实验结果表明,抑制FASN介导的脂质合成能够显著抑制HMGA1促进的CRC肿瘤发生,证明FASN是HMGA1促进肿瘤的关键介导分子,并提示其在CRC干预中具有潜在应用价值。
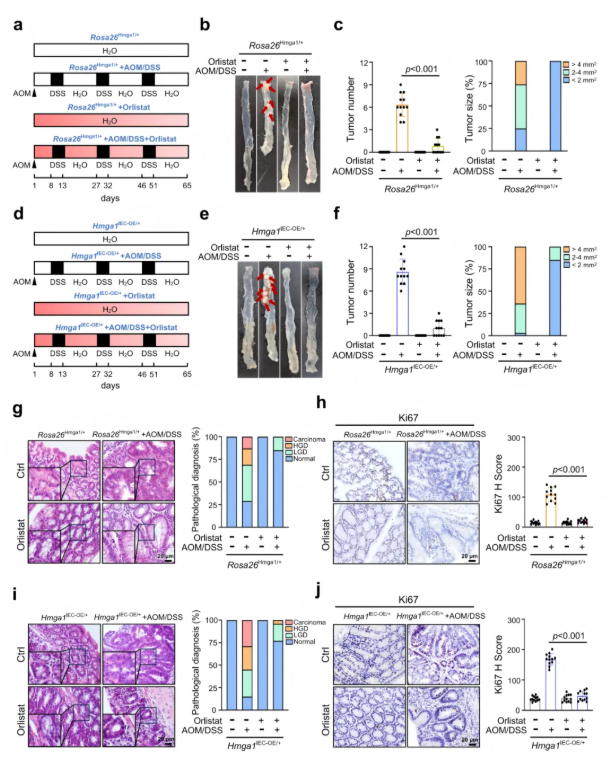
图8. 抑制FASN介导的脂质合成可有效抑制HMGA1促进的CRC肿瘤发生
研究结论
本研究揭示了HMGA1在CRC发生发展中的致癌作用及其机制。HMGA1通过增强SREBP1对FASN启动子的转录活性,上调FASN表达,促进de novo脂肪酸合成和脂质积累,从而推动肠上皮细胞和肿瘤细胞增殖。高脂饮食可削弱HMGA1缺失的保护作用,而FASN抑制剂orlistat则有效抑制HMGA1过表达诱导的肿瘤发生。这些结果表明,HMGA1-FASN脂质代谢通路是CRC的关键促癌机制,为HMGA1高表达CRC的治疗提供了潜在干预靶点。
百趣生物非靶标代谢流:背靠2W+代谢物标准品自建库,将代谢物的鉴定准确度提升至98.5%以上,并且极大地提升了同位素追踪的覆盖范围,能够在鉴定到上千种代谢物的同时进行稳定同位素标记的追踪。