
英文标题:Macrophages recycle phagocytosed bacteria to fuel immunometabolic responses
中文标题:巨噬细胞对吞噬的细菌进行回收利用以促进免疫代谢反应
发表期刊:nature
影响因子:48.5
研究背景
巨噬细胞作为免疫系统的关键组成部分,通过吞噬作用清除入侵的微生物是其核心功能之一。这一过程中,巨噬细胞会将细菌等病原体内化至吞噬体,并与溶酶体融合形成吞噬溶酶体,通过酶解等作用降解病原体。然而,长期以来,对于吞噬后细菌降解产物的具体代谢去向,以及这些产物如何影响巨噬细胞自身的代谢活动和免疫功能,学界的认知仍较为有限。
已知营养物质不仅是细胞能量和生物合成的基础,还能调控免疫细胞的激活、功能与分化,而巨噬细胞凭借其强大的吞噬能力,可能具备通过替代途径获取营养以驱动代谢的潜力。同时,巨噬细胞在识别微生物后,会通过模式识别受体(PRRs)启动免疫信号通路,进而重组细胞内代谢途径,使免疫反应强度和特异性与所遭遇的威胁相匹配。但细菌的活力是否会影响这一过程,以及背后存在怎样的调控机制,尚未得到充分阐明。因此,探究巨噬细胞对吞噬细菌的代谢利用方式,及其与细菌活力相关的调控机制,成为理解免疫代谢交叉调控的重要方向。
长按二维码研究结果
1、细菌的吞噬作用为线粒体供能
为探究细菌吞噬是否能为巨噬细胞提供营养,研究对比了灭活无毒革兰氏阴性大肠杆菌(KEC)刺激与脂多糖(LPS)激活TLR4后巨噬细胞的代谢重编程差异:
基因表达差异:两种刺激下,骨髓来源巨噬细胞(BMDMs)的炎性细胞因子(IL-6、TNF、IL-1β)产生及ERK1/2磷酸化水平相似,但刺激4小时后RNA测序显示约1200个基因差异表达,KEC处理组中与代谢过程和代谢物膜转运蛋白相关的基因高表达(图1a-b),且溶质载体(SLC)家族氨基酸转运蛋白基因的差异表达使其具有特定表达谱(图1c),表明完整细菌的摄取与LPS单独激活TLR4引发的代谢及营养处理通路重编程不同。
线粒体相关基因调控:在MitoCarta数据库的1140个线粒体蛋白编码基因中,74个差异表达基因使KEC刺激的巨噬细胞呈现特定线粒体基因特征,推测被吞噬的KEC可为线粒体氧化磷酸化提供营养。
代谢指标验证:
在含葡萄糖的“呼吸培养基”中,KEC组和LPS-微球组均使细胞外酸化率(ECAR)升高(图1d),且LPS和KEC诱导的ATP浓度相似,提示模式识别受体(PRR)激活后糖酵解通量被诱导以满足能量需求。
与其他组相比,KEC显著提高氧消耗率(OCR)(图1d),而损害吞噬体成熟会阻止该诱导(图1e)。
尽管LPS和KEC处理组的氨基酸浓度相似,但非必需氨基酸(NEAAs)与LPS联合添加可使OCR升高至类似KEC处理的水平(图1f),单独添加丝氨酸等与LPS联合也能诱导OCR,支持吞噬溶酶体降解KEC可通过提供包括氨基酸在内的营养为线粒体代谢供能的假设。
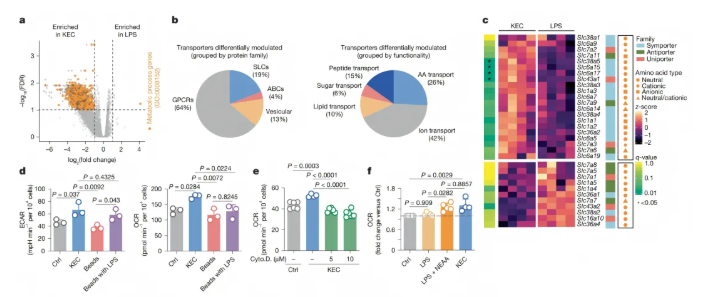
图1. 吞噬灭活细菌为巨噬细胞的线粒体呼吸链供能
2、被吞噬的细菌提供代谢中间体
为探究巨噬细胞对吞噬细菌降解产物的利用情况,研究通过系列实验得出以下结论:
细菌来源氨基酸参与蛋白质合成:采用稳定同位素标记氨基酸培养技术(SILAC)标记灭活大肠杆菌(SILAC-KEC),与巨噬细胞共培养后发现,直接接触时可检测到含¹³C标记精氨酸或赖氨酸的巨噬细胞特异性肽段,Trans-well分离时则无(图2b)。延长共孵育时间未增加此类肽段,提示细菌来源氨基酸在吞噬后迅速整合,可能在巨噬细胞激活后受抑。51种含细菌来源氨基酸的蛋白质在所有时间点均存在,主要与先天免疫反应或糖酵解等代谢途径相关,且多数丰度随时间增加。用v-ATPase抑制剂伴胞霉素A破坏吞噬体成熟后,巨噬细胞内多种氨基酸浓度降低,含¹³C标记的精氨酸或赖氨酸肽段数量显著减少(图2c),表明吞噬溶酶体对KEC的降解是氨基酸回收用于新蛋白质合成的必要条件。
KEC提供广泛代谢中间体:在仅含Uniformly ¹³C标记葡萄糖的培养基中培养大肠杆菌,得到标记的U-[¹³C]-KEC,处理巨噬细胞后发现,细胞与细菌直接接触时,KEC来源的¹³C大量掺入巨噬细胞代谢物,Trans-well分离时则无(图2e)。三羧酸循环代谢物和非必需氨基酸中¹³C显著掺入,必需氨基酸中未检测到(图2f),且衣康酸中¹³C富集,其掺入依赖细胞与细菌直接接触(图2f)。
体内及跨细菌种类的代谢回收:向小鼠腹腔注射DAPI标记的U-[¹³C] KEC,两小时后分选的DAPI⁺吞噬细胞中¹³C掺入代谢物明显(如谷氨酸、谷胱甘肽同位素体),DAPI⁻细胞中不明显(图2g)。吞噬U-[¹³C] KEC的细胞中检测到含¹³C代谢物,吞噬未标记KEC的细胞中则无,表明吞噬细胞在体内可代谢回收死细菌。此外,巨噬细胞吞噬Uniformly ¹³C标记的其他灭活革兰氏阴性菌和阳性菌后,均有细菌来源¹³C掺入多种代谢物(图2h),说明其代谢吞噬细菌的能力不限于大肠杆菌。
综上,吞噬死细菌可作为营养来源,其代谢物能被回收利用到巨噬细胞代谢中。
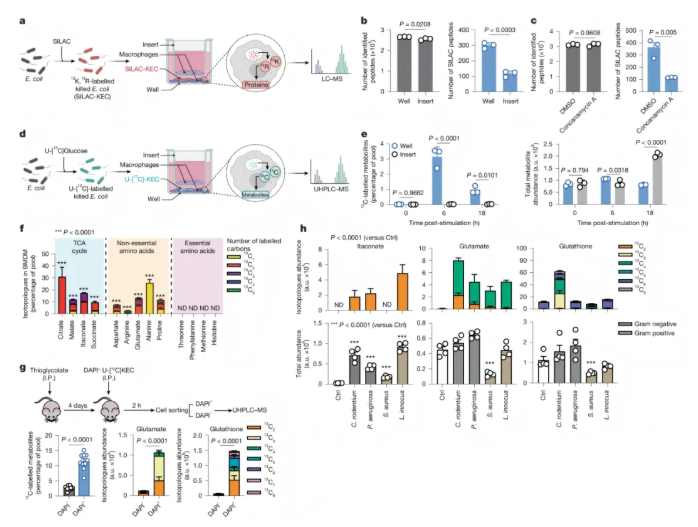
图2. 吞噬灭活细菌为巨噬细胞提供代谢中间体
3、RagA调控被摄入细菌的回收利用
研究探究了调控巨噬细胞对KEC降解产生的微生物源营养物质回收利用的机制,重点关注了RagA和mTORC1通路的作用:
细胞中mTORC1通路可感知溶酶体氨基酸并调节代谢物流出,其激活与Rag GTPases相关。研究发现,Ras依赖性信号通路对KEC代谢回收无显著影响,但共聚焦成像显示30分钟后RagA和mTOR定位于含荧光脂多糖微球的吞噬溶酶体(图3a-b),且KEC激活mTORC1通路的效率不及LPS(图3c)。
通过转基因和敲除小鼠模型实验,发现RagAGTP/△巨噬细胞中mTORC1组成型激活,导致KEC来源的氨基酸摄取利用减少、代谢物回收降低(图3d-e);而RagA缺陷型巨噬细胞中,含¹³C标记的代谢物增多(图3f),表明RagA或mTORC1通路调控着细菌来源营养物质的去向。
此外,mTORC1还关联着代谢物回收与巨噬细胞代谢重编程。参与谷胱甘肽(GSH)生物合成的代谢物在LPS和KEC处理组中存在差异,且其产生与吞噬溶酶体对细菌的处理相关。RagAGTP/△巨噬细胞中GSH合成相关代谢物浓度及细菌来源¹³C掺入量更低(图3g-i),而RagA缺陷型巨噬细胞则相反(图3j-k)。
综上,RagA作为代谢调节因子,将吞噬溶酶体的营养感知与针对死细菌吞噬的谷胱甘肽生物合成相联系。
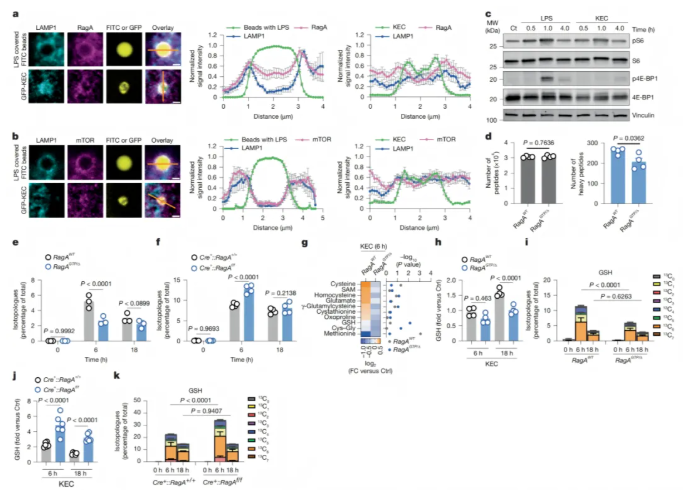
图3. RagA调控吞噬细菌的代谢回收
4、微生物的存活状态驱动代谢回收
研究探究了微生物存活状态对巨噬细胞代谢重编程及内化微生物回收利用的影响:
专业吞噬细胞可区分活微生物与灭活微生物,虽巨噬细胞对大肠杆菌(EC)和灭活大肠杆菌(KEC)的吞噬与降解程度相似,但主成分分析显示两者刺激后的巨噬细胞代谢存在显著差异(图4a)。KEC处理组中谷胱甘肽(GSH)代谢是富集程度最高的通路,相关代谢物(如GSH、氧化型谷胱甘肽(GSSG))更丰富,且衣康酸产生更多、活性氧(ROS)水平更低(图4b-e),这种代谢特征会持续存在,且源于代谢通量和营养处理通路重塑而非相关基因转录重编程。
对细菌存活状态的识别会调节巨噬细胞对微生物碳的整合能力。吞噬灭活的U-[¹³C]大肠杆菌(KEC)的巨噬细胞中,完全标记的代谢物更少,而同位素体比例更高(图4f),表明KEC是更好的代谢中间产物提供者。RagA组成型激活会降低KEC刺激下细菌来源¹³C的回收率。
在营养匮乏条件下,吞噬EC会显著降低巨噬细胞活力,而KEC可提供额外营养维持其活力(图4g)。KEC通过提供代谢中间产物抑制ROS产生,其诱导的细菌来源¹³C在衣康酸及GSH合成相关氨基酸中掺入量更高(图4h)。此外,向EC刺激的巨噬细胞培养基添加氨基酸,可将IL-1β产生减少至KEC处理组水平(图4i)。
综上,虽活细菌和灭活细菌均可作为营养来源,但灭活细菌来源的碳能更有效整合,支持巨噬细胞在恶劣环境中的活力,并维持如GSH生物合成等特异性代谢途径。
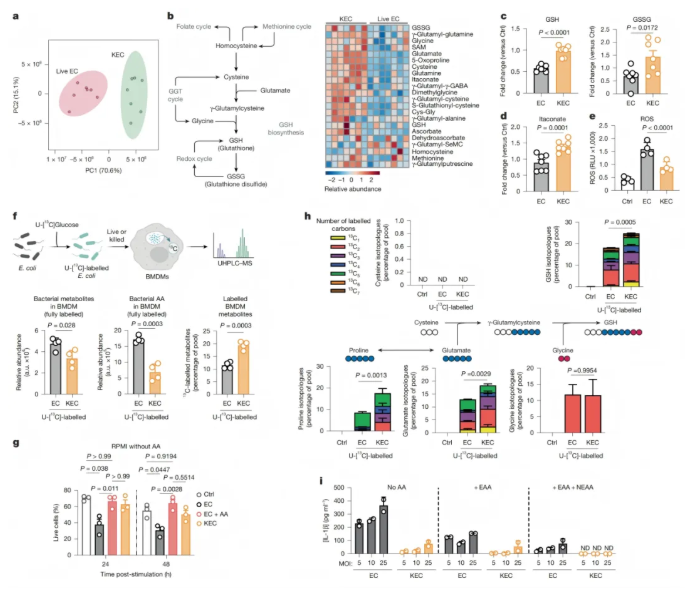
图4. 细菌的存活状态决定了被吞噬细菌的代谢回收
5、环磷酸腺苷(cAMP)是微生物死亡的一种代谢信号
研究探究了调控被吞噬细菌代谢回收的信号及相关代谢反应,发现环磷酸腺苷(cAMP)和AMPK–mTORC1轴的关键作用:
代谢组学分析显示,cAMP在灭活大肠杆菌(KEC)中特异性积累,是细菌死亡的代谢标志(图5a)。巨噬细胞吞噬KEC后,cAMP转化为AMP,其细胞内完全¹³C标记的AMP浓度高于吞噬活大肠杆菌(EC)的细胞(图5b)。核苷合成途径的代谢物(如AMP)掺入KEC来源碳最多,且KEC能维持AMP库,而EC会特异性减少AMP库(图5c-d),同时EC和KEC对ATP库的诱导作用相似(图5e)。
KEC可激活AMPK(使AMPKα亚基Thr172磷酸化)并抑制mTORC1(降低其靶标磷酸化水平),该过程在刺激后30分钟即发生(图5f)。激活AMPK或抑制mTORC1,能使EC刺激的巨噬细胞活性氧(ROS)产生、IL-1β分泌降至KEC处理组水平,且RagA敲除会增加衣康酸产生(图5g)。
综上,cAMP是细菌死亡的代谢信号,KEC通过提供AMP激活AMPK并抑制mTORC1,二者共同调控巨噬细胞对细菌存活状态的特异性免疫代谢反应。
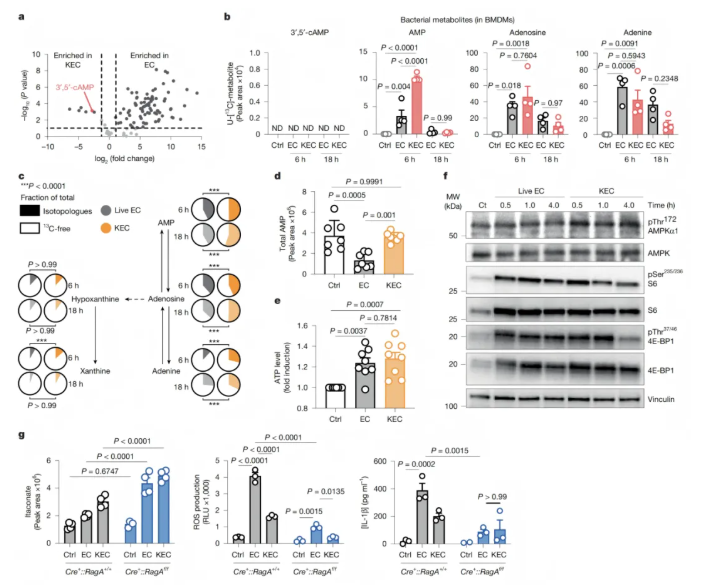
图5. 灭活细菌来源的cAMP维持巨噬细胞的抗氧化反应
研究小结
本研究围绕巨噬细胞对吞噬细菌的代谢利用机制展开,揭示了多个关键过程与调控信号。研究发现,巨噬细胞可通过吞噬作用摄取灭活细菌(如KEC)的降解产物,将其中的氨基酸整合到蛋白质合成中,且这一过程依赖吞噬溶酶体的降解功能;RagA/mTORC1通路在此过程中起调控作用,RagA激活会抑制细菌来源营养物质的回收利用,而其缺陷则促进该过程,并影响谷胱甘肽等抗氧化相关代谢物的生成。
同时,细菌存活状态对巨噬细胞代谢重编程影响显著,灭活细菌相比活细菌能更高效地为巨噬细胞提供代谢中间产物,支持其在营养匮乏环境中的活力,增强抗氧化反应(如产生更多GSH和衣康酸、降低ROS水平)并调节炎症因子分泌。此外,环磷酸腺苷(cAMP)是细菌死亡的代谢标志,在巨噬细胞吞噬后转化为AMP,通过激活AMPK、抑制mTORC1,参与调控巨噬细胞对细菌存活状态的特异性免疫代谢反应。这些发现为理解巨噬细胞的营养利用与免疫代谢调节机制提供了重要见解。
百趣生物非靶标代谢流:不局限于特定的代谢通路,可以全面地研究代谢物流量随时间的动态变化规律,对流经代谢途径的代谢流量进行定量分析,能够很好地解释代谢物在代谢途径中的变化,将代谢组学的研究提升到更高的水平和层次。通过添加稳定同位素标记的底物可以进一步扩展非靶标代谢组学的功能,因为代谢底物可以代谢成各种下游产物,其标记原子可以被跟踪。百趣生物非靶代谢流依托新一代代谢组学NGM 2的数据库、质控体系,背靠2W+标准品数据库,将代谢物的鉴定准确度提升至98%以上,并且极大地提升了同位素追踪的覆盖范围,能够在鉴定到上千种代谢物的同时进行稳定同位素标记的追踪。