在凋亡、自噬、焦亡等各种形式的程序性细胞死亡(Programmed Cell Death, PCD)中,2012年提出的铁死亡作为科研人员的“新宠”,其研究热度居高不下。除了文章呈井喷式增长,近几年各类资助项目中,也频频出现“铁死亡”的身影。作为自带流量的科研“新星”,铁死亡已成为很多科研人员瞄准的新方向。今天小趣系统的梳理铁死亡的发生机制、检测指标及组学方向研究思路,进而帮助各位老师快速了解铁死亡~
铁死亡是一种铁依赖的程序性细胞死亡,由不受限制的磷脂过氧化作用引起的,这一过程的发生主要依赖于代谢产物活性氧(reactive oxygen species, ROS)、含多不饱和脂肪酸链的磷脂(phospholipid containing polyunsaturated fatty acid chain, PUFA-PL)和铁积累的增加。另外,细胞内和细胞间信号、环境压力也可以通过调节细胞代谢和ROS水平,进而间接影响铁死亡(图1)[1]。
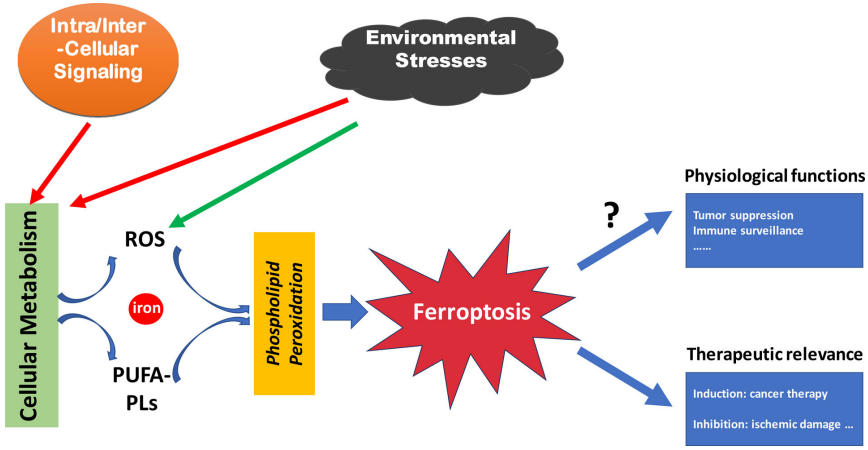
图1 铁死亡概述
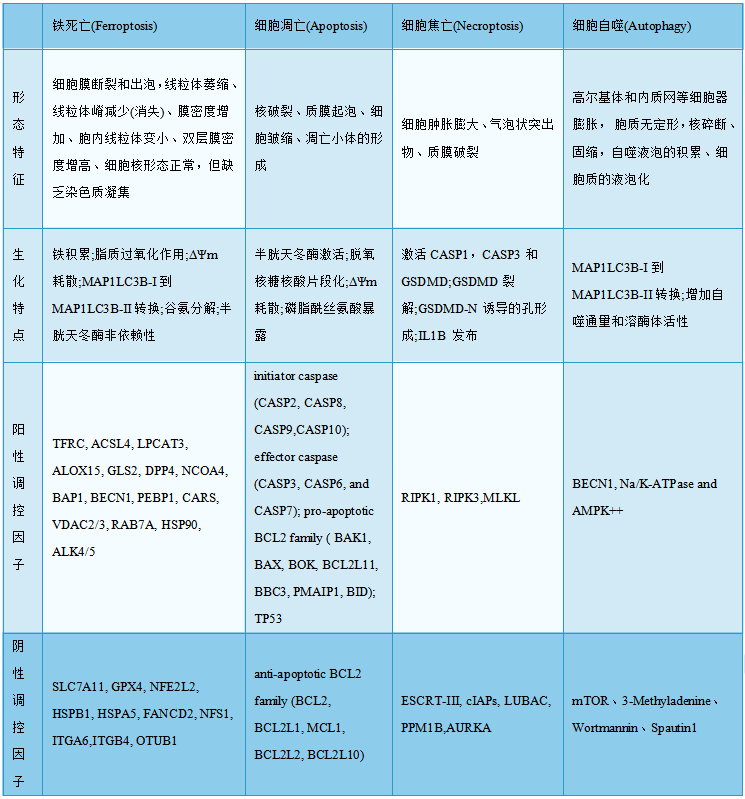
作为区别于细胞凋亡、细胞焦亡、细胞自噬的新型的细胞程序性死亡方式,铁死亡在形态学、生物学及基因水平上均呈现出明显的不同(表1)。
表1 4种细胞死亡途径和相关的形态及其生化标志特征[2]
细胞在正常代谢过程中,一方面可以产生过氧化脂质的底物和氧化剂,另一方面又可以产生防止脂质过氧化的抑制剂。而铁死亡的发生过程必然存在着脂质过氧化,并且阻止这种过氧化脂质积累的天然防御机制必然会受到损害(图2)[3]。下面我们一起来看看哪些途径会对铁死亡造成影响~
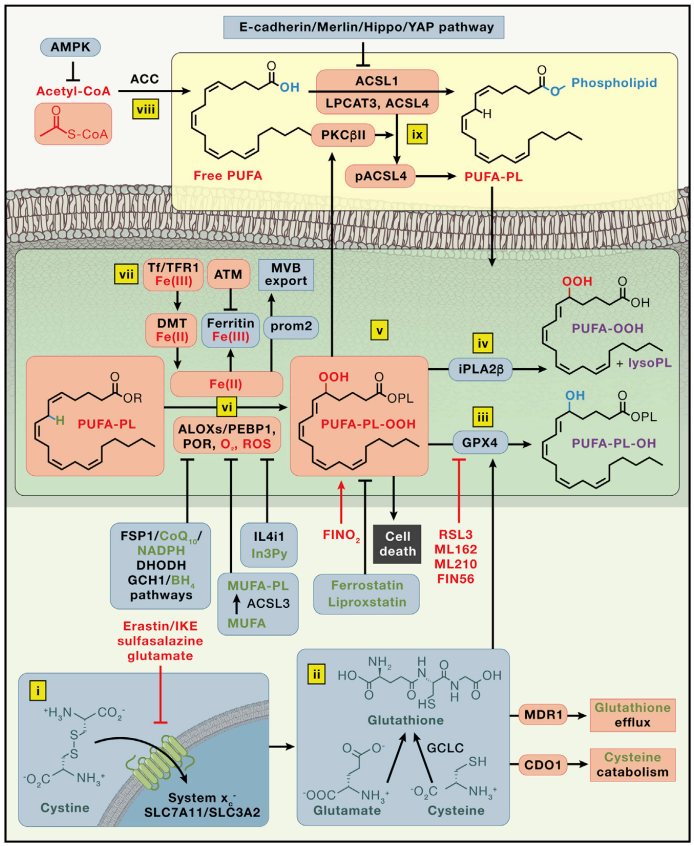
图2 铁死亡调节机制
1. 经典Cystine/GSH/GPX4调节途径
胱氨酸(Cystine)经嵌于细胞膜表面的SLC7A11和SLC3A2二聚体(System Xc-)进入细胞,然后被氧化成半胱氨酸(Cysteine),然后经谷氨酸-半胱氨酸连接酶(GCLC)和谷胱甘肽合成酶(GSS)催化合成谷胱甘肽(GSH)。谷胱甘肽过氧化物酶4(GPX4)作为一种硒蛋白,能够利用GSH能够将细胞中过氧化磷脂(PUFA phospholipid hydroperoxides, PUFA-PL-OOHs)还原成非致命性PUFA磷脂醇(PUFA phospholipid alcohols, PUFA-PL-OHs),进而起到抵制细胞铁死亡的作用。
Erastin和RSL3代表着前两类铁死亡诱导化合物,前者通过抑制系统 xc-阻止胱氨酸的摄取,引起胞内半胱氨酸耗竭,进而导致膜结构发生破坏导致细胞的死亡;后者通过抑制GPX4发挥作用,使过氧化磷脂堆积,进而诱导细胞铁死亡的发生。
2. 不依赖GPX4途径调节途径
与GPX4作为铁死亡中枢抑制因子的调控途径不同,已经发现的①铁死亡抑制蛋白1(ferroptosis suppressor protein, FSP1)/CoQ10、②二氢乳清酸脱氢酶 (DHODH))和③环GTP水解酶1(GTP cyclohydrolase, GCH1)/四氢生物蝶呤 (BH4)途径可以通过独立于GPX4的方式来抑制铁死亡。
① NAD(P)H/FSP1/CoQ10途径
FSP1是一种CoQ氧化还原酶。从机制上来看,由于FSP1具有NADH:泛醌还原酶活性,能够还原泛醌形成泛醇,直接减少脂质自由基的生成,或促进维生素E的再生,从而抑制脂质的过氧化和铁死亡。
② DHODH途径
DHODH还可以通过产生线粒体内膜中CoQH2从而在线粒体中抑制铁死亡,这是因为CoQH可以作为一种自由基捕获型抗氧化剂(radical trapping antioxidant)来阻止脂质过氧化,从而抑制铁死亡。
③ GCH1/BH4/DHFR途径
GCH1通过其代谢产物二氢喋呤(BH2)和四氢喋呤(BH4)来抑制铁死亡主要通过两个方面的机制抑制铁死亡:1)GCH1 产生亲脂性抗氧化剂BH4,其功能类似于CoQ10以防止脂质过氧化;2)GCH1介导脂质膜环境的重塑从而增加还原CoQ10的丰度,同时消耗铁死亡的诱导因素PUFA-PL。
3. 脂代谢途径
铁死亡最终是由特定膜脂的过氧化作用驱动的,而脂质发生过氧化的倾向取决于其碳氢键的强度。由于在相邻的C=C双键之间存在异常弱的C-H键,因此PUFA特别容易发生过氧化。在酶ACSL4和LPCAT3的作用下,PUFA与磷脂酰乙醇胺(phosphatidyl ethanolamine,PE)结合形成多不饱和脂肪酸的磷脂(PUFA-PE),后者易受脂氧合酶(LOX)介导的自由基引发的氧化的影响,诱发铁死亡。
4. 铁代谢途径
进入细胞的Fe3+被STEAP3还原成Fe2+后,会优先形成各种铁结合复合物,参与到各项生理和生化反应中去。多余的Fe2+会在细胞中积累,形成不稳定铁池,通过参与芬顿途径诱导ROS的产生,促进脂质过氧化的发生,最终诱发细胞铁死亡的发生。
除了以上所述途径,铁死亡还受到细胞代谢、AMPK信号通路、鲨烯积累等因素的影响。随着研究的不断深入,铁死亡的调控机制不断被丰富~
2022年,纽约哥伦比亚大学铁死亡专家 Brent R, Stockwell 教授在 Cell上发表了一篇关于铁死亡十周年的综述,指出目前如果研究铁死亡需要鉴定的主要标志物和基因,主要包括:(1)脂质过氧化标志物,(2)线粒体特征 ,(3)基因检测,(4)TfR1亚细胞定位变化检测。四种标志物至少要检测三种,其中脂质过氧化是必须要检测的选项。
检测脂质过氧化的方法包括:
(1)硫代巴比妥酸反应物质(TBARS)测定法;
(2)LC-MS/MS直接检测氧化脂质异前列腺素及脂质组;
(3)C11-BODIPY荧光探针检测脂质氧化物水平;
(4)通过抗体检测脂质过氧化的产物或产物的加合物,例如抗HNEFerAb抗体、HNEJ-1抗体和抗丙二醛(MDA)加合物1F83抗体。
通过LC-MS/MS能够检测到更多的脂质物质及脂质氧化产物,百趣能够提供脂质组及氧化脂质组检测,助力铁死亡组学研究。除此之外,还能基于质谱技术对谷胱甘肽以及铁含量进行绝对定性定量分析~
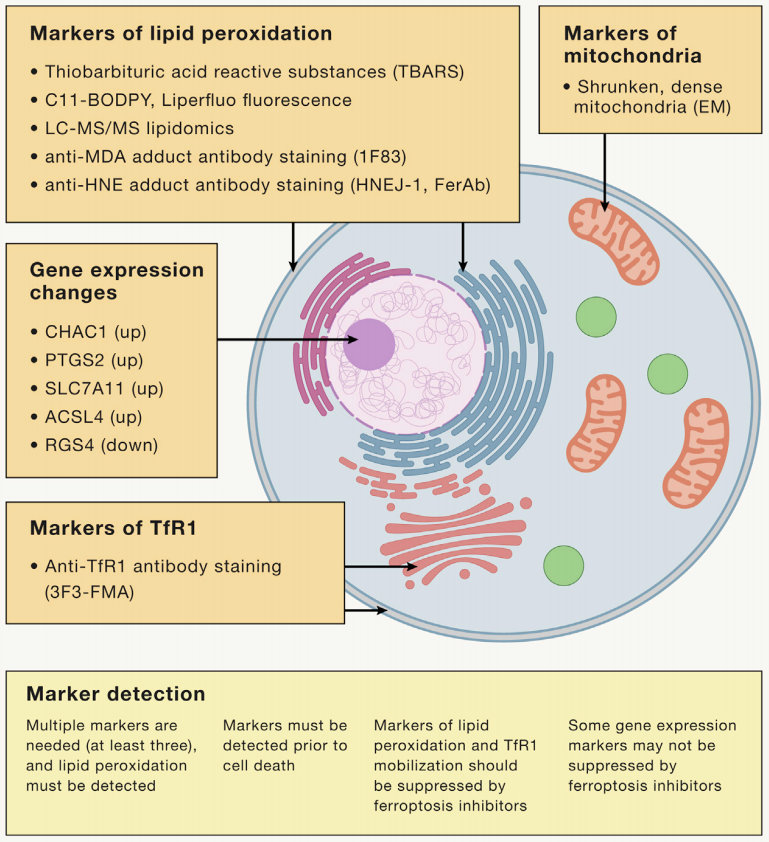
图3 铁死亡标志物
文章标题:Ferroptosis heterogeneity in triple-negative breast cancer reveals an innovative immunotherapy combination strategy
中文标题:三阴性乳腺癌铁死亡异质性的揭示,为LAR亚型精准治疗带来新方向
客户单位:复旦大学附属肿瘤医院
发表期刊:Cell Metabolism
影响因子:29.0
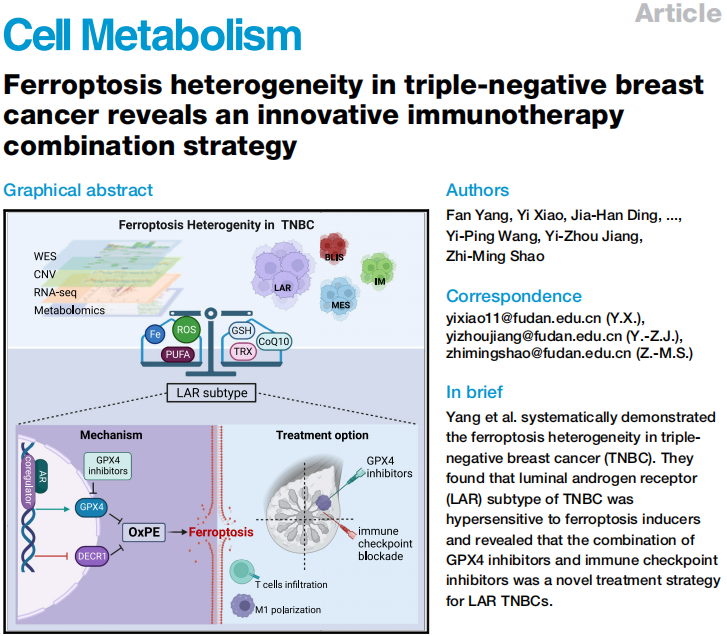
研究目的:铁死亡(Ferroptosis)是一种非凋亡性和铁依赖性细胞死亡方式,近年来在肿瘤研究领域表现活跃。在Fe2+或酯氧合酶的作用下,含多不饱和脂肪酸链的磷脂(PE-PUFAs)发生脂质过氧化,诱导细胞铁死亡,这一过程受多种代谢途径的调控,然而TNBC铁死亡的特性仍未揭示。因此TNBC“复旦分型”仍需进一步的研究,探寻新的治疗靶点,以发现TNBC新的治疗突破口。
研究结果:通过多组学数据集分析和体内外实验验证系统地揭示了TNBC“复旦分型”各亚型具有铁死亡异质性,其中LAR亚型肿瘤细胞ROS积累,脂肪酸代谢富集,脂氧合酶过度表达,并操纵GSH代谢防止铁死亡的发生。且LAR亚型肿瘤对铁死亡抑制剂、尤其是GPX4抑制剂敏感,是铁死亡治疗最为敏感的亚型。
点击查看完整推文:项目文章(IF 31.373) | 三阴性乳腺癌铁死亡异质性的揭示,为LAR亚型精准治疗带来新方向

文章标题:Heme-deficient primitive red blood cells induce HSPC ferroptosis by altering iron homeostasis during zebrafish embryogenesis
中文标题:缺血红素的原始红细胞在斑马鱼胚胎发育过程中通过改变铁稳态诱导HSPC铁死亡
客户单位:中国科学院动物研究所
发表期刊:Development
影响因子:4.6
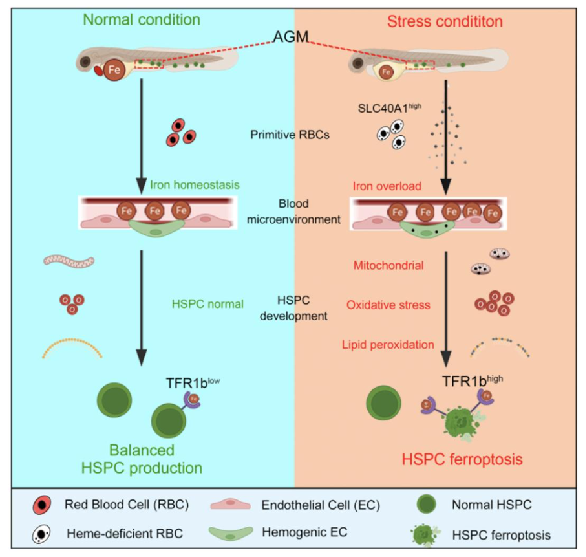
研究目的:近年研究表明,骨髓微环境中铁的浓度能影响造血干细胞命运决定,其中适量的铁可以促进造血干祖细胞分化和多谱系重建,而过量的铁可以直接诱导细胞铁死亡。然而,胚胎发育过程中,铁稳态是否影响造血干祖细胞的产生也仍不清楚。
研究结果:该研究证实了在alas2和alad突变体中,血红素缺陷的初级红细胞导致造血干祖细胞铁死亡。造血干祖细胞通过转铁蛋白受体响应铁过载环境,导致过量铁的摄入。过量铁引起造血干祖细胞活性氧水平升高,细胞氧化应激压力升高。结合脂质氧化组学检测,证实了花生四烯酸类脂质过氧化是导致造血干祖细胞铁死亡的直接原因。总的来说,该研究揭示了红细胞铁稳态在造血干祖细胞发育过程中的重要作用,为铁代谢异常导致的恶性血液疾病提供了潜在的临床指导。
参考文献:
[1]. Jiang X, Stockwell BR, Conrad M. Ferroptosis: mechanisms, biology and role in disease. Nat Rev Mol Cell Biol. 2021 Apr;22(4):266-282. doi: 10.1038/s41580-020-00324-8. Epub 2021 Jan 25.
[2]. Tang D, Kang R, Berghe TV, Vandenabeele P, Kroemer G. The molecular machinery of regulated cell death. Cell Res. 2019 May;29(5):347-364. doi: 10.1038/s41422-019-0164-5. Epub 2019 Apr 4.
[3]. Stockwell BR. Ferroptosis turns 10: Emerging mechanisms, physiological functions, and therapeutic applications. Cell. 2022 Jul 7;185(14):2401-2421. doi: 10.1016/j.cell.2022.06.003.
[4]. Yang F, Xiao Y, Ding JH, Jin X, Ma D, Li DQ, Shi JX, Huang W, Wang YP, Jiang YZ, Shao ZM. Ferroptosis heterogeneity in triple-negative breast cancer reveals an innovative immunotherapy combination strategy. Cell Metab. 2023 Jan 3;35(1):84-100.e8. doi: 10.1016/j.cmet.2022.09.021.Epub 2022 Oct 17.
[5]. Lv P, Liu F. Heme-deficient primitive red blood cells induce HSPC ferroptosis by altering iron homeostasis during zebrafish embryogenesis. Development. 2023 Oct 15;150(20):dev201690. doi: 10.1242/dev.201690. Epub 2023 Jun 15.