细胞异质性是生物体的基本特征,在生理和病理过程中均发挥关键作用。作为时下最炙手可热的研究领域,单细胞分析技术能够分析单个细胞的复杂性,深化对细胞异质性在细胞功能、生物体发育及疾病中作用的认识。其中单细胞转录组技术自出现以来已经逐渐成熟,而单细胞代谢组学技术一直处于探索阶段。
2026年2月9日,百趣生物首席科学家中国科学院上海有机化学研究所生物与化学交叉研究中心朱正江研究员及其团队在全球生命科学领域方法论研究顶级期刊nature methods(IF=32.1)发表题为“Deep-coverage single-cell metabolomics enabled by ion mobility-resolved mass cytometry”的研究论文。
本研究使用离子淌度质谱流式技术(ion mobility-resolved mass cytometry technology),创造性地结合高通量单细胞注射技术和离子淌度质谱,显著提升了单细胞代谢物检测的灵敏度、稳定性。并结合自研的MetCell深度单细胞代谢组学数据处理平台,实现了在单细胞中超过5000个代谢物的检测,其中约800个代谢物使用了MS2鉴定,比之现有的技术方法提升了3-10倍,并具有广泛的代谢物监测动态范围,灵敏度低至阿托摩尔级(10-18moL)。
研究团队使用该技术对衰老小鼠的45603个原代肝细胞进行了分析,对细胞的类型及代谢分型进行了精准注释,揭示了肝细胞衰老过程中存在的独特代谢状态与异质性。

文章标题:Deep-coverage single-cell metabolomics enabled by ion mobility-resolved mass cytometry
发表期刊:nature methods
影响因子:32.1
研究结论
01.离子迁移质谱流式技术
事实上基于质谱技术与流式细胞技术整合的质谱流式技术已经在单细胞分析中崭露头角,然而单纯的质谱流式技术在检测的灵敏度、稳定性和覆盖深度方面存在巨大挑战。由于单细胞中代谢物的浓度通常会低至10-18moL,极低的浓度导致质谱仪采集到的信噪比(signal-to-noise ratios, SNRs)极低,进而影响代谢组学检测的灵敏度和稳定性。而离子淌度技术(ion mobility, IM)能够根据代谢物离子的大小,形状以及碰撞截面积(collision cross-section, CCS)将代谢物的离子在气相中预先分离,更重要的是IM分离前的选择性离子积累,能够大幅增强代谢物离子的信号同时减少其他细胞组分对信号的干扰。研究团队将这两大模块创造性的结合在一起,开发了离子淌度质谱流式技术(图1a)。
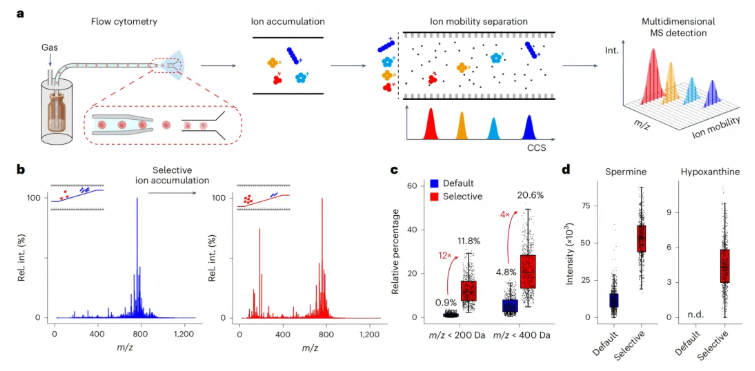
图1.离子淌度质谱流式技术
该方法实现了25-40个细胞每分钟的高通量检测速度,更重要的是使用该方法具有高达94.3%的单细胞事件率,根据高速摄像机的拍摄显示,在毛细管内观察到的88个细胞事件中,有83个被确认为单细胞事件(图2a,b)。
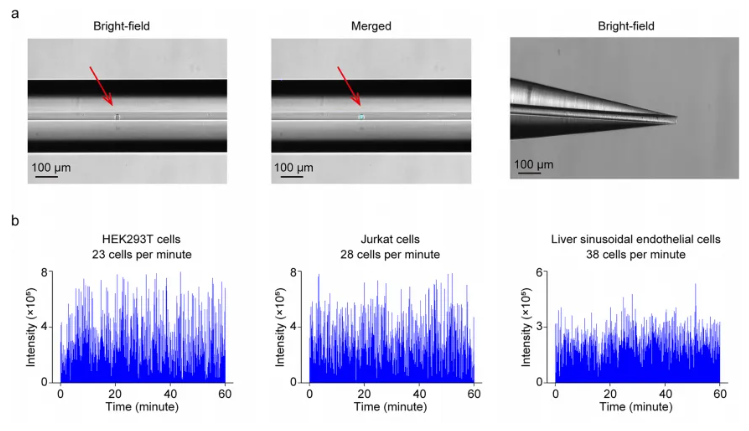
图2.基于离子淌度质谱的单细胞代谢组学分析
同时IM技术的引入,可以在IM分离前对离子进行选择性的富集,从而减少脂质等细胞内其他组分的干扰(图1a),研究团队通过调整IM采集数据的富集时间以及调整IM斜坡电压,以利于提高系统对于低质量范围离子的信号采集效率(图1b),显著提高了低质量范围离子的信号强度,对于m/z小于400Da和200Da的离子分别增加了4倍和12倍(图1c)。
02.细胞叠加法用于提升峰检测稳定性
然而单纯的提高灵敏度并不能完全的解决问题,极低的SNRs会进一步放大噪音信号对数据的影响,导致大量缺失值,最终使得数据难以精确分析(图3a)。为了解决这个问题研究团队开发了一种基于细胞叠加的技术路线,实现了在保持细胞异质性特征的基础上,提升单细胞代谢物检测的稳定性(图3b)。主要包括两步:(1)通过细胞叠加实现稳定的峰检测;(2)在单个细胞中对检测到的峰进行靶向提取。如乙酰肉碱在叠加了600个细胞的信号后,其SNR从3.3提升到了157.6(图3c,d),通过这样的方法,研究团队观测到,在100个测试的代谢物中SNR的中位数提升了33倍(图3f)。经过细胞叠加后,再对单个细胞中代谢物进行靶向提取,就能够显著降低代谢物的缺失率,同样以乙酰肉碱为例,其缺失率从83%降低到了1%(图3g),对于整体100个测试代谢物的缺失率从82%降低至6%(图3i)。
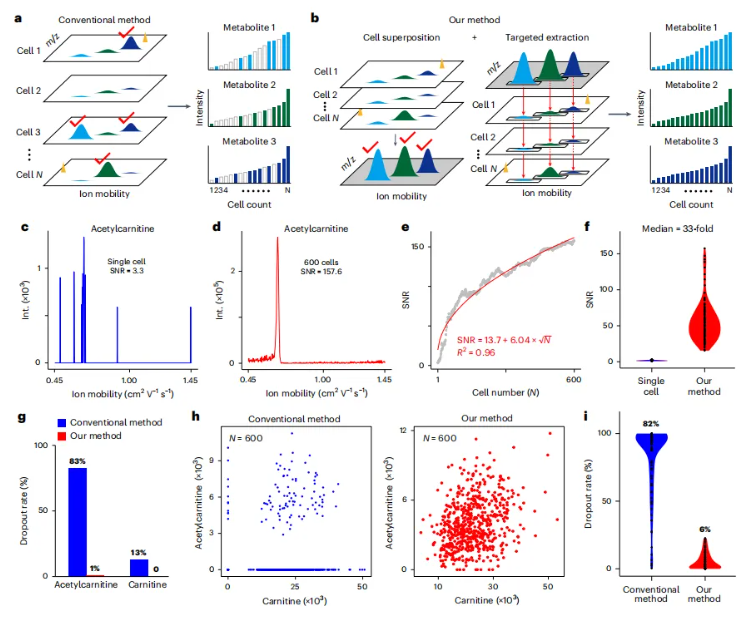
图3.通过细胞叠加技术实现稳健的单细胞代谢谱分析
03.MetCell工作流程
由于单细胞代谢数据量巨大以及数据的特殊性,研究团队自研了针对离子淌度质谱的单细胞代谢数据分析平台MetCell,能够一站式完成单细胞数据采集、细胞叠加、峰检测、峰定量、代谢物注释全流程工作(图4a)。在对HepG2细胞系的120分钟的检测时间内,共采集到3094个细胞(图4b),在单个细胞中检测到5718个代谢物(或特征峰),并通过MS1和CCS值鉴定出了其中的1356个代谢物(图4c),并对其中的1350个代谢物进行了MS2鉴定,按照MSI(国际代谢组学标准倡议)的标准分别鉴定出了,188个Level 1代谢物、126个Level 2代谢物、332个Level 3代谢物和124个Level 4代谢物(图4d)。研究团队同时使用该平台测试了其他不同的细胞类型,分别检测出了5074-6975个代谢物(或特征峰),并通过MS2鉴定出了其中的533-622个代谢物(图4f,g)。值得注意的是,本次跨细胞研究中共有389种代谢物使用了化学标准品进行了验证,是迄今为止所有单细胞代谢研究中报道最多的,而其他方法,目前还仅仅停留在MS1鉴定水平,少量MS2匹配也基本没有使用化学标准品进行验证。
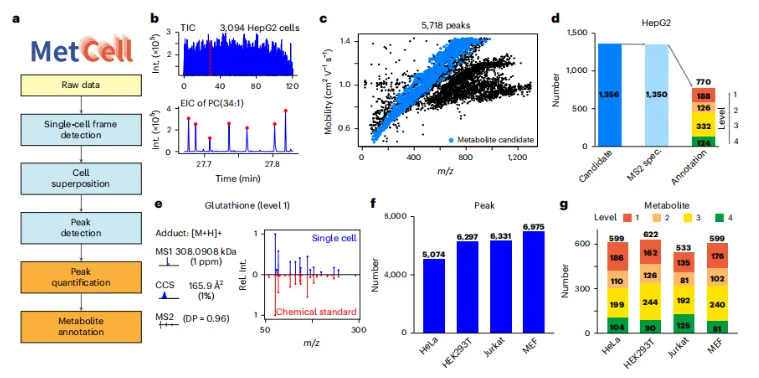
图4.MetCell单细胞代谢组学工作流程
04.单细胞代谢组学中的定量灵敏度
在解决了代谢物鉴定的问题后,研究团队为了进一步评估本方法对于代谢物定量的灵敏度,将同一份细胞样本提取后分为两份,分别进行传统LC-MS代谢组学技术与单细胞代谢技术分析(图5a)。LC-MS检测数据表明,细胞中腺嘌呤的含量为18.4±1.4 amol/细胞,这与单细胞代谢技术测得的腺嘌呤中位值相符,通过数据换算得到单细胞代谢技术测得得腺嘌呤浓度为7.5-32.4 amol/细胞(图5b),通过计算SNR,预估本方法对于腺嘌呤得检测限为8.2 amol/细胞,使用同样的方法研究团队分析了烟酰胺、精氨酸和丙氨酸在单细胞中得浓度,其检测限分别为54.7 amol/细胞、0.9 fmol/细胞和2.8 fmol/细胞(图5c)。根据此前的研究报道96%的代谢物在细胞中的浓度大于1 amol/细胞,使得大多数代谢物都可能使用本研究的技术被检测到。
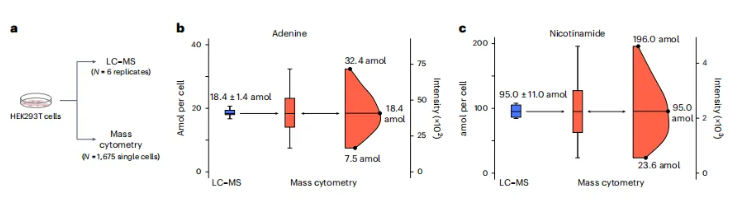
图5.单细胞代谢组学的定量灵敏度
05.小鼠肝脏细胞类型的代谢注释
最后研究团队使用离子淌度质谱流式技术对衰老小鼠肝脏进行了大规模单细胞代谢组学研究,成功实现了代谢物在细胞类型注释中的应用。研究团队分别收集了年轻组和老年组小鼠样本(图6a),通过单细胞代谢技术,共采集到45603个细胞,其中年轻组24055个细胞,老年组21548个细胞,共检测到5659个代谢物(或特征峰)并鉴定了其中的809个代谢物(图6b,c)。为了研究不同的肝细胞类型,研究团队分离了四种主要的肝细胞类型,肝细胞、肝窦内皮细胞(LSECs)、库普弗细胞和肝星状细胞(HSCs),并通过单细胞代谢技术在不同细胞类型中鉴定出了特异性标志代谢物(如,肝细胞中麦芽四糖和麦芽三糖水平会显著升高)(图6d),基于这些代谢标志物,研究团队实现了对不同肝细胞的单细胞代谢分类(图6e,g)。总而言之,研究团队成功标注了25,370个肝细胞、2,898个HSCs、3,333个库普弗细胞和6,935个LSECs,充分展现了本方法的强大能力。
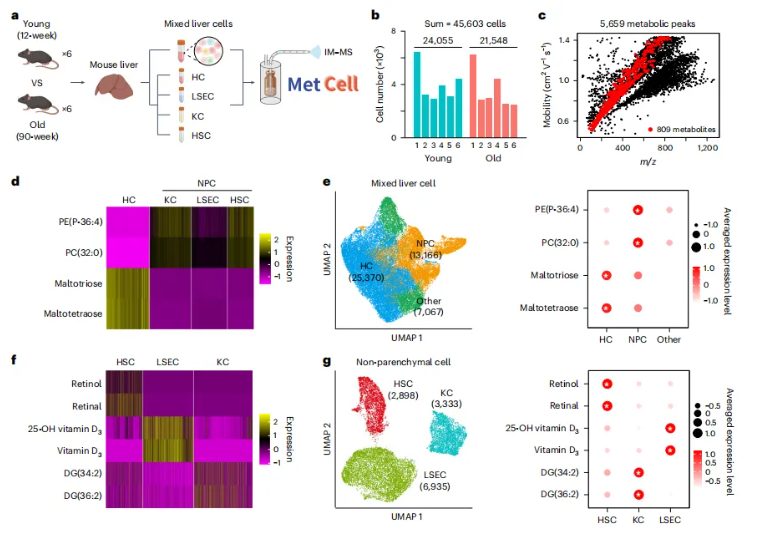
图6.小鼠肝脏细胞类型的代谢注释
研究总结
本研究将高通量单细胞注射技术结合离子淌度质谱实现了高通量单细胞代谢组学检测,实现了在单细胞中超过5000个代谢物的检出,其中约800个代谢物使用了MS2信息进行了准确鉴定,将单细胞代谢组学技术推进到了新的时代。
关注百趣代谢组学公众号,后续将为大家带来本文的详细深度解读!
单细胞代谢组学:代谢物是细胞生命活动的“最终产物”(如氨基酸、葡萄糖等小分子),其种类和含量直接反映细胞功能。传统代谢组为bulk层面所有细胞的代谢物的平均值,难以体现单个细胞特征,而单细胞代谢组学可在单个细胞层面解析代谢物信息,精准捕捉代谢差异,突破传统分析掩盖细胞异质性的局限。该技术广泛应用于肿瘤微环境异质性解析、干细胞分化追踪等领域,为揭示细胞个体差异相关生物学过程、解析复杂疾病代谢调控机制提供高分辨率工具。