
英文标题:Butyrate-producing Faecalibacterium prausnitzii suppresses natural killer/T-cell lymphoma by dampening the JAK-STAT pathway
中文标题:产丁酸的普拉梭菌通过抑制JAK-STAT通路抑制自然杀伤/T细胞淋巴瘤
发表期刊:Gut
影响因子:25.8
文章简介
自然杀伤/T细胞淋巴瘤(NKTCL)是一种高度侵袭性的恶性肿瘤,预后极差,尽管在治疗策略上已有不少努力,但患者临床结局仍不理想,尤其是初始非蒽环类药物治疗后复发或进展的患者,中位总生存期和无进展生存期较短。近年来,肠道菌群在维持人体稳态中发挥的关键作用逐渐明晰,其结构改变(即菌群失调)与多种疾病存在密切关联,而菌群-肠道-淋巴瘤轴也成为淋巴瘤临床管理的潜在靶点。已有研究表明,肠道菌群可作为NKTCL的非侵入性诊断和预后生物标志物,且普拉梭菌作为健康成人肠道内的关键共生菌,被认为具有下一代益生菌的潜力。此外,致癌的JAK-STAT通路因具有促增殖功能,在NKTCL的发病机制中扮演着重要角色。然而,肠道共生菌与NKTCL进展的相互作用,以及共生菌产生的中间代谢产物是否会影响NKTC结局等问题,仍有待阐明。
技术路线
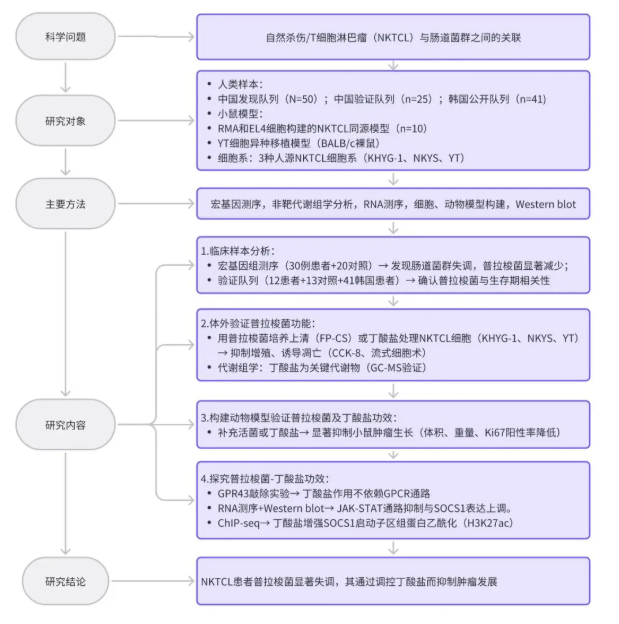
文章简介
1、肠道普拉梭菌的减少与NKTCL患者生存期缩短相关
对30例NKTCL患者和20例健康对照者(HCs)组成的发现队列进行粪便宏基因组测序。与对照组相比,NKTCL患者的α多样性(Simpson指数)显著降低、β多样性(Bray-Curtis指数)显著升高(图1A-B),提示其肠道菌群整体多样性下降且菌群结构失衡;PCA分析表明,NKTCL患者的肠道菌群特征与健康人群存在显著差异(图1C)。
LEfSe分析筛选出16个差异丰度菌种(图1D)。结果显示,产丁酸盐的普拉梭菌在NKTCL组中减少最为显著(图1D),且被LEfSe分析确定为最具代表性的标志菌种(图1E)。值得注意的是,这一发现在韩国NKTCL公开队列中得到进一步验证(1F)。进一步分析发现,普拉梭菌的缺失与NKTCL患者更差的生存结局(包括无进展生存期和总生存期)存在显著关联(图1G-I),且在包含12例NKTCL患者和13例健康对照的验证队列中得到一致验证(图1J-M)。这些结论提示,肠道普拉梭菌在NKTCL患者中具有显著的有益作用。
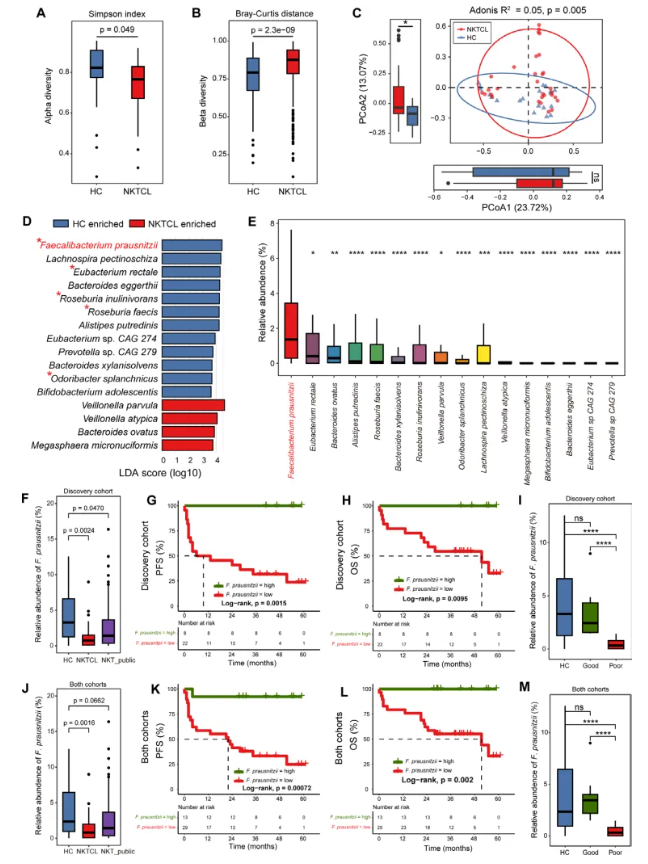
图1. NKTCL患者肠道微生物群的改变
2、普拉梭菌在同源肿瘤荷瘤小鼠模型中抑制NKTCL的发展
为评估普拉梭菌是否具有抗NKTCL的保护作用,研究人员通过向C57BL/6小鼠分别接种RMA和EL4细胞,构建了两种同源肿瘤荷瘤模型(图2A)。结果显示,相较于接受无菌PBS或非致病性大肠杆菌MG1655的对照组,活体普拉梭菌干预组小鼠的肿瘤负荷显著降低,表现为肿瘤体积缩小、重量减轻及生物发光强度显著降低(图2B-F)。值得注意的是,活体普拉梭菌灌胃处理未影响荷瘤小鼠的整体生长(图2G),证实了该干预方案的安全性。此外,活体普拉梭菌干预组小鼠肿瘤组织中Ki67阳性细胞比例显著低于对照组(图2H-I),提示肿瘤细胞增殖受到明显抑制。微滴式数字PCR和普拉梭菌特异性荧光原位杂交证实,接受活体普拉梭菌灌胃的小鼠肠道内普拉梭菌丰度显著提升(图2J)。这些抑瘤效应在EL4肿瘤荷瘤模型中得到进一步验证(图2K-N),结果表明,预防性给予普拉梭菌不仅显著抑制肿瘤形成,还提高了小鼠的生存率(图2O-P)。
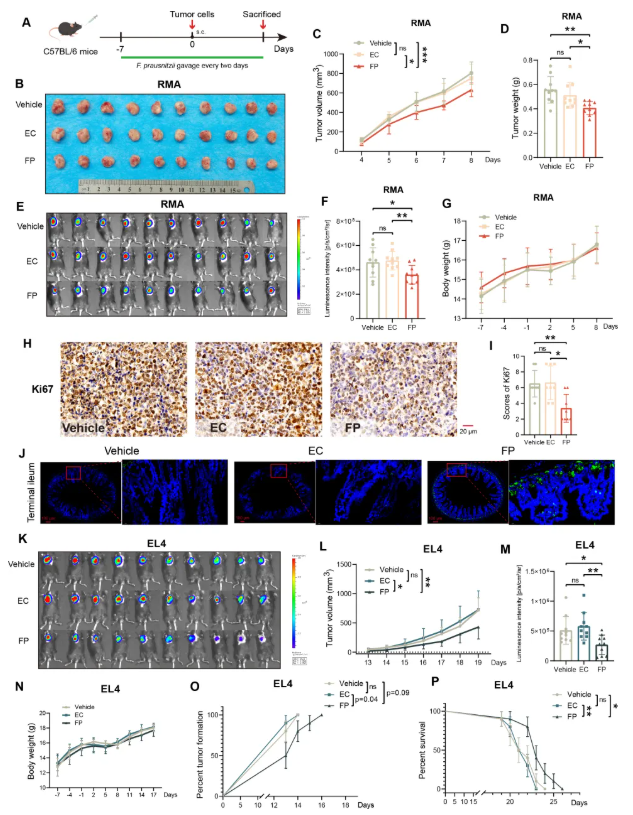
图2. 普拉梭菌(FP)在NKTCL小鼠模型中表现出抗肿瘤作用
3、丁酸盐是普拉梭菌产生的具有抑制NKTCL功能的代谢物
为探究普拉梭菌的抑癌机制,研究人员将三种人类NKTCL细胞系(KHYG-1、NKYS和YT)分别与普拉梭菌培养上清液(FP-CS)、灭活菌体、大肠杆菌MG1655培养上清液、空白培养基及无菌PBS共培养。结果显示,经FP-CS处理的NKTCL细胞存活率显著降低(图3A-C),凋亡率明显升高(图3D-I),表明普拉梭菌的抗肿瘤作用源于其代谢产物。值得注意的是,细胞存活率的下降及凋亡率的升高均具有时间依赖性(图3A-C, E, G, I),提示FP-CS具有持续抗肿瘤效应。
为明确FP-CS中抑制NKTCL生长的关键活性成分,研究人员采用代谢组对FP-CS进行代谢物初筛。结果显示,与普拉梭菌空白培养基相比,FP-CS中的丁酸水平显著升高(图3J)。短链脂肪酸(SCFAs)靶标代谢组学检测进一步表明,FP-CS中丁酸水平显著升高(图3K-M)。与此同时,粪便菌群功能分析结果显示,“不良”生存组中丁酸合成通路“丙酮酸途径”显著下调(图3L);重要的是,代谢组学分析显示NKTCL患者粪便和血浆中的丁酸水平均显著低于健康对照(图3N-O),而补充活性普拉梭菌却可显著提升荷瘤小鼠粪便和血浆中的丁酸水平(图3P-Q)。综合以上结果表明,丁酸可能是普拉梭菌产生并发挥其抗NKTC肿瘤作用的关键介质。
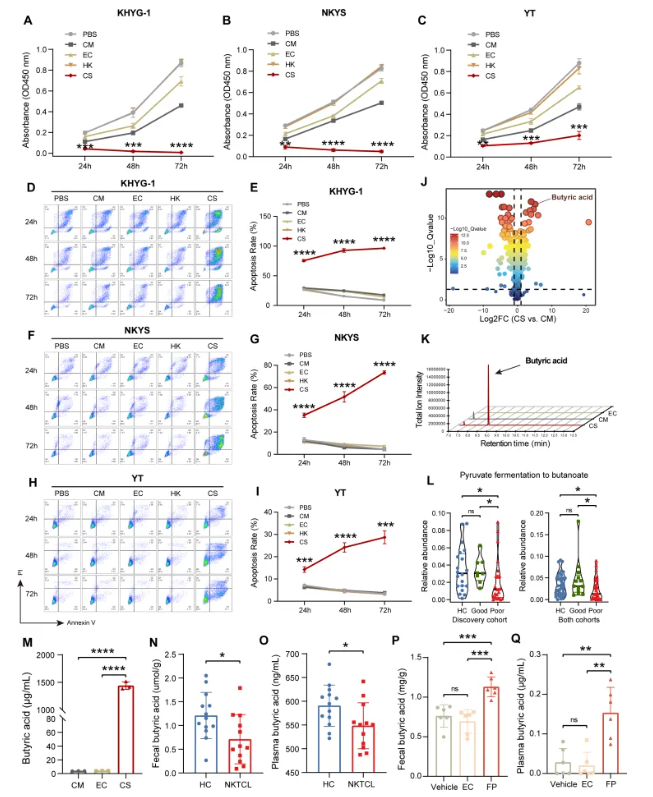
图3. FP-CS通过代谢物丁酸盐抑制NKTCL
4、丁酸盐在体外能抑制NKTCL进展
为直接验证丁酸盐的抑瘤效应,研究人员用不同浓度的丁酸钠溶液分别处理 KHYG-1、NKYS和YT细胞系24小时、48小时及72小时。结果显示,丁酸钠呈现出与FP-CS相似的抗肿瘤效果,具体表现为抑制细胞增殖(图4A-C)和促进细胞凋亡(图4D-I)。这种效应同时具有时间依赖性(图4A-C、E、G、I)和浓度依赖性。相较于PBS对照组,丁酸盐处理通过上调Cleaved caspase-3、Cleaved caspase-7和Cleaved caspase-9等多种凋亡标志蛋白的表达水平,显著诱导NKTCL细胞发生凋亡(图4J-O)。
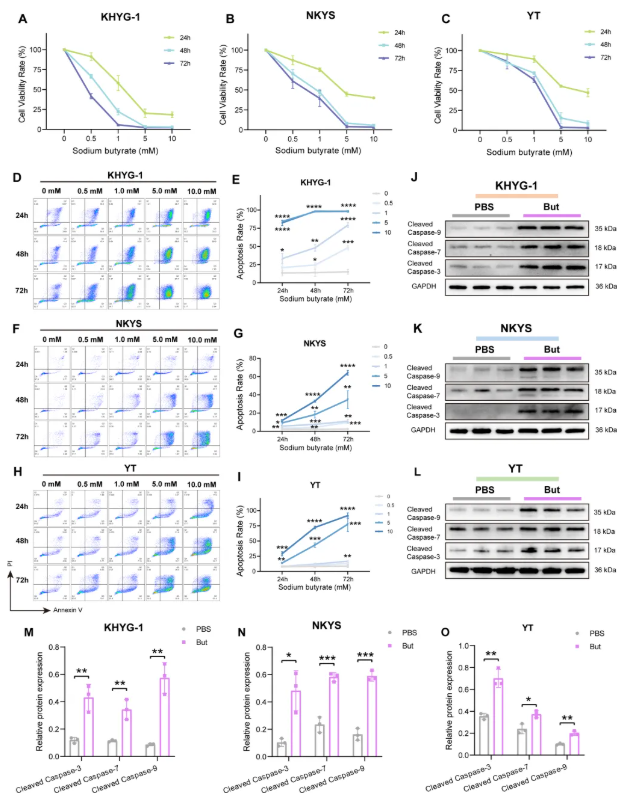
图4. 普拉梭菌产生的丁酸盐可抑制NKTCL细胞增殖并促进其凋亡
5、丁酸盐在体内能抑制NKTCL进展
研究人员进一步利用RMA和EL4细胞构建的两种同源荷瘤小鼠模型验证丁酸盐的抗癌效果(图5A)。肿瘤挑战后,小鼠通过饮用水接受100 mM或300 mM浓度的丁酸盐处理。实验结果显示,两种浓度的丁酸盐均能显著抑制NKTCL发展,表现为肿瘤负荷减少、Ki67阳性细胞率降低、肿瘤形成率下降及生存期延长(图5B-H, K-O)。值得注意的是,300 mM浓度组较100 mM组展现出更强的抑瘤效应,这与该组荷瘤小鼠粪便和血浆中丁酸盐水平显著升高相关(图5I-J)。此外,在经YT细胞构建的BALB/c裸鼠异种移植模型中,给予与普拉梭菌培养上清中丁酸浓度相当的16 mM丁酸盐溶液,也观察到显著的肿瘤抑制效果。
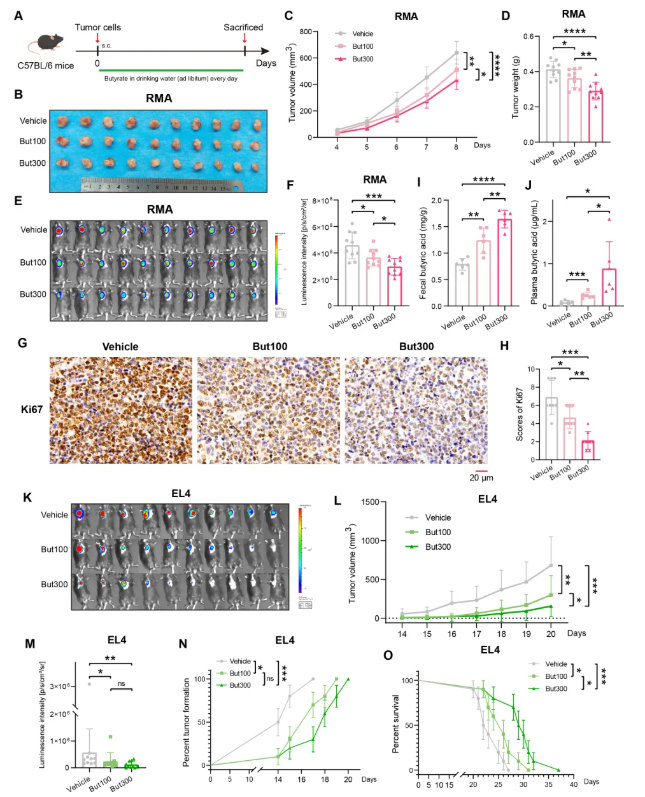
图5. 丁酸盐在两种NKTCL同基因肿瘤模型小鼠中减轻肿瘤发展
6、FP-CS与丁酸盐通过上调负反馈调节因子SOCS1抑制JAK-STAT信号通路
为探究丁酸盐介导淋巴瘤抑制的分子机制,研究人员对KHYG-1和NKYS细胞进行RNA测序分析,发现FP-CS和丁酸盐处理均能显著减弱JAK-STAT信号通路的激活(图6A-B)。蛋白质印迹分析进一步证实,经FP-CS和丁酸盐处理的三种人类NKTCL细胞系中,JAK-STAT通路关键分子(尤其是p-JAK3、p-STAT3和p-STAT5)均受到显著抑制(图6D-G)。
SOCS1是SOCS家族中唯一在两个细胞系的RNA测序数据中均呈现表达升高的成员(图6C),作为JAK-STAT通路的负反馈调节因子,其蛋白表达在经 FP-CS或丁酸盐处理的所有三种人类NKTCL细胞系中均显著上调(图6D-G),突显了其在丁酸盐介导的JAK-STAT通路抑制中的核心作用。值得注意的是,通过免疫组化分析发现,在丁酸盐饮水干预的RMA荷瘤小鼠模型中,p-STAT3显著受抑而SOCS1表达显著升高(图6H-J)。
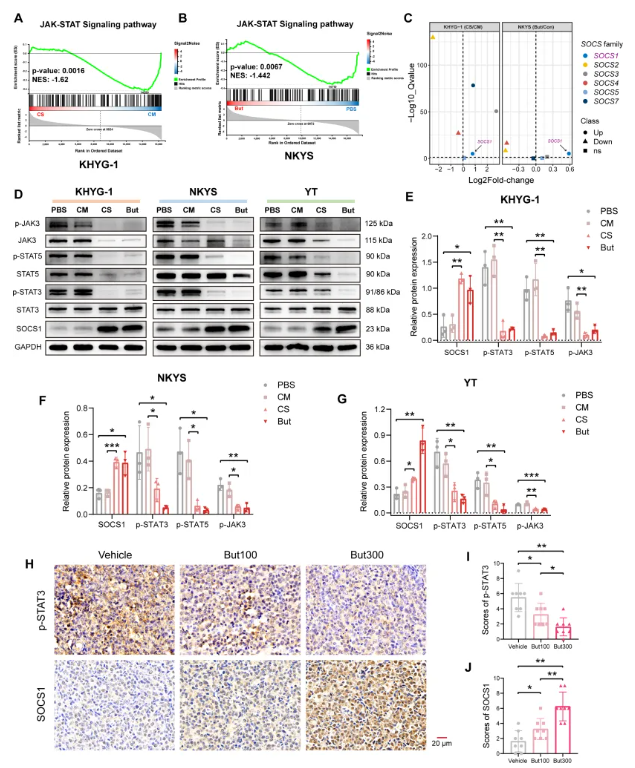
图6. FP-CS和丁酸盐通过升高SOCS1抑制JAK-STAT通路
7、丁酸盐通过增强SOCS1基因启动子区域的组蛋白H3K27ac而非激活G蛋白偶联受体抑制JAK-STAT通路激活
丁酸盐主要通过两种机制影响细胞信号传导:激活G蛋白偶联受体(GPRs)或抑制组蛋白去乙酰化酶(HDAC)。研究发现,丁酸盐处理的三组NKTCL细胞及荷瘤小鼠中,组蛋白H3乙酰化水平(HDAC抑制的间接指标)显著升高(图7A-D);且敲除GPR43后,丁酸盐诱导的组蛋白乙酰化、SOCS1上调及JAK-STAT通路抑制均未受影响,证实其作用不依赖GPRs。蛋白质印迹分析进一步证实,丁酸盐可显著诱导组蛋白乙酰化,通过上调SOCS1表达抑制JAK-STAT通路激活(图7E-H),且呈现浓度和时间依赖性效应(图7I-J)。ChIP-seq检测显示,丁酸盐处理后转录起始位点附近的乙酰化基因显著增多(图7K),其中SOCS1基因启动子区域的组蛋白H3第27位赖氨酸乙酰化(H3K27ac)显著富集(图7L)。综上表明,组蛋白表观遗传修饰(H3K27ac)的改变促进了SOCS1蛋白表达,进而抑制JAK-STAT通路激活,最终实现对NKTCL的肿瘤抑制效果(图7M)。