文章标题:Mycobacterium tuberculosis suppresses host DNA repair to boost its intracellular survival
客户单位:同济大学附属上海市肺科医院
期刊:Cell Host & Microbe
影响因子:30.3
百趣提供服务:600MRM
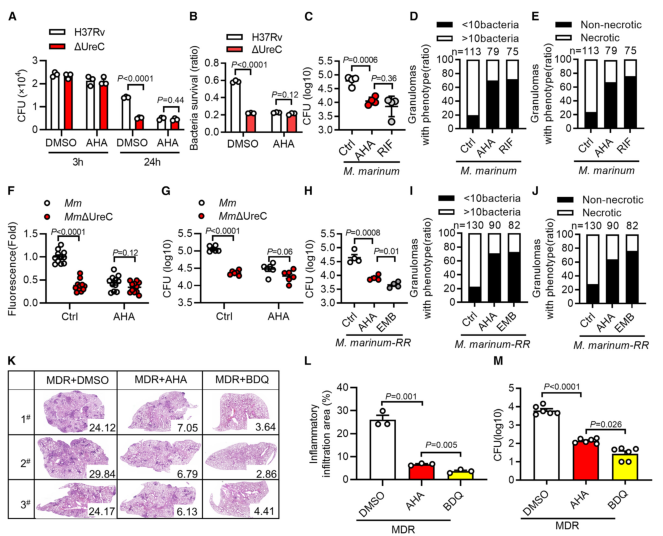
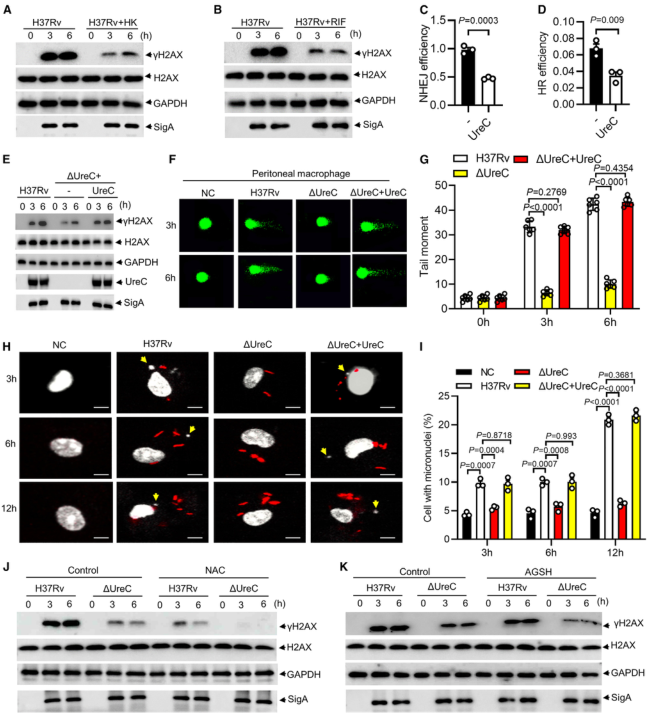
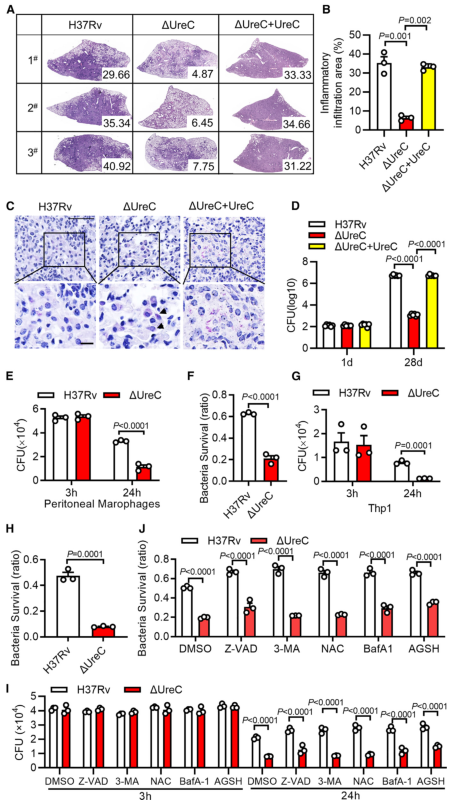
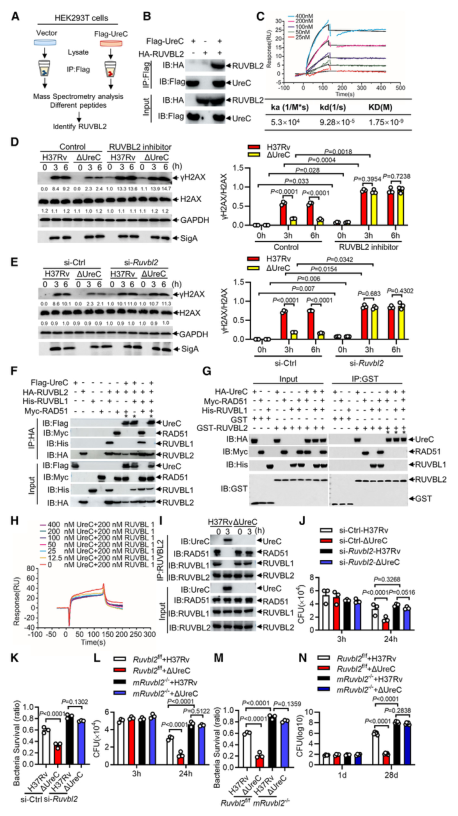
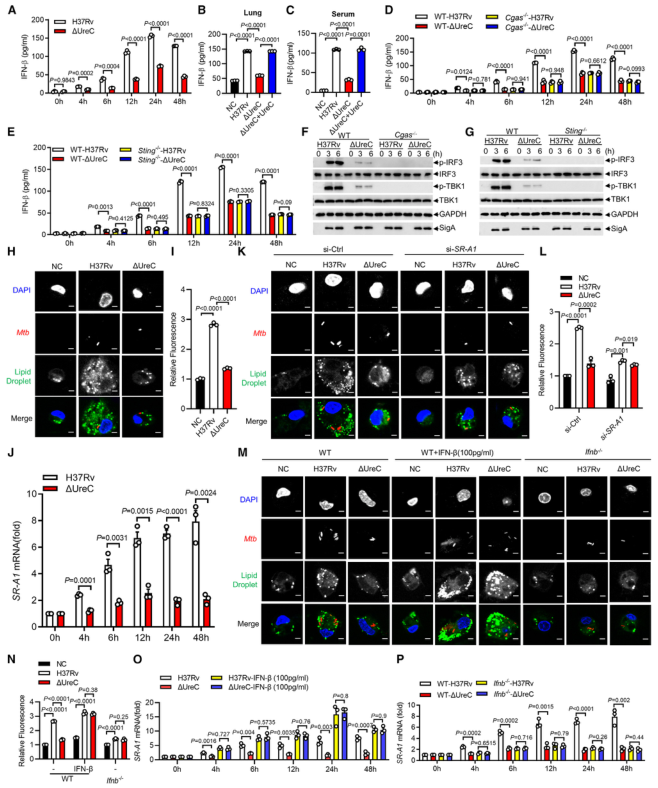
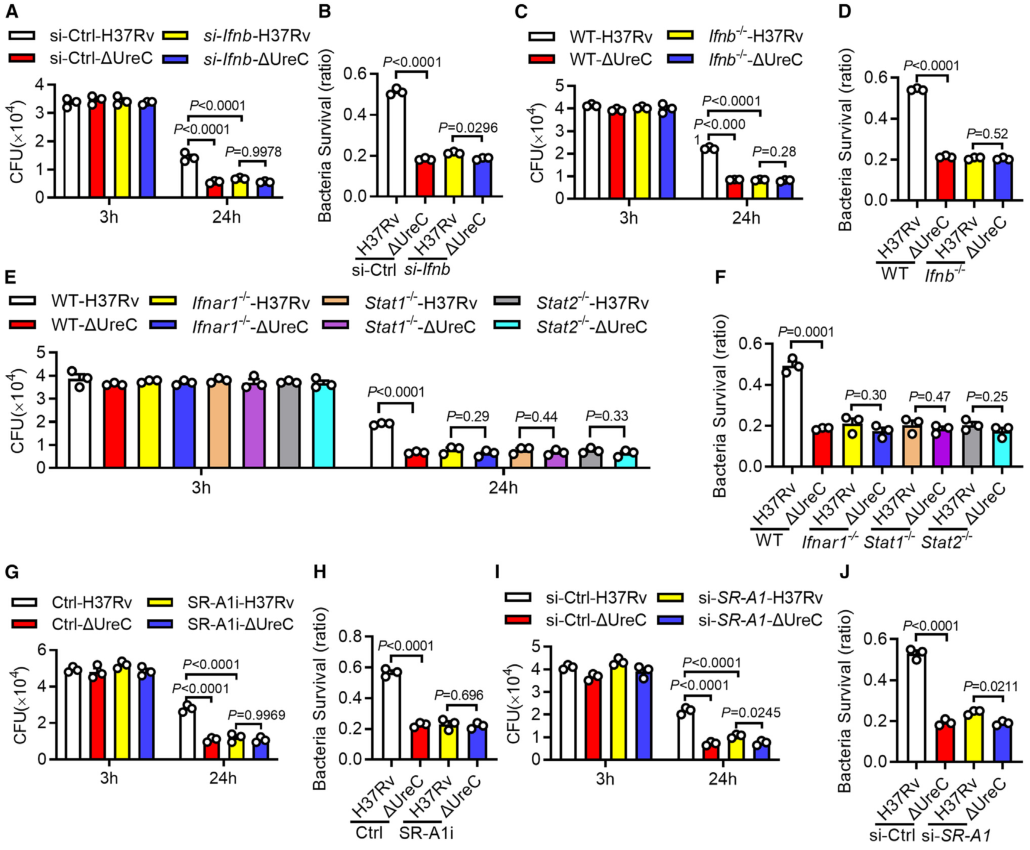
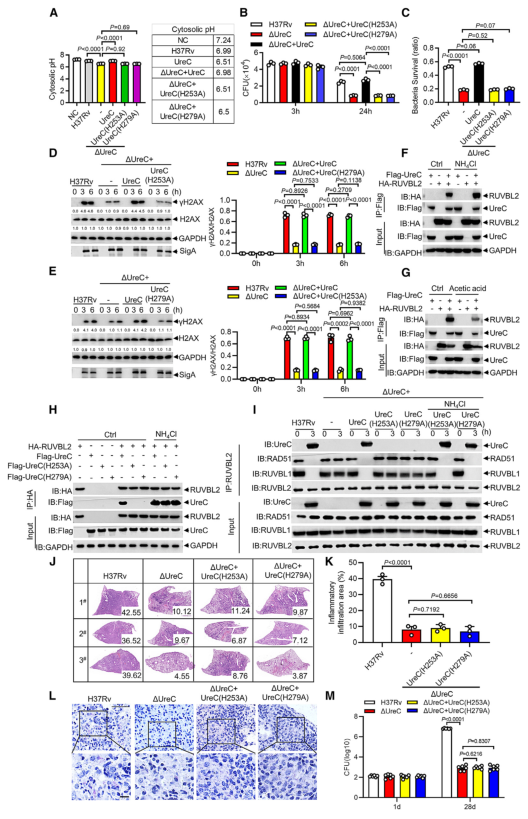
毒性强的结核分枝杆菌菌株引起DNA双链断裂(double-strand breaks, DSBs)并诱导基因组不稳定。Mtb在分泌系统的帮助下分泌超过300种分泌因子。Mtb SecA2通路分泌的效应器导致DSBs,Mtb Rv2346c(ESAT-6蛋白家族成员)通过促进氧化应激诱导巨噬细胞DNA损伤。考虑到在Mtb感染的巨噬细胞或小鼠肺组织中持续存在的DSBs导致修复效率低下,本研究假设Mtb通过其细胞内分泌蛋白干扰宿主DNA修复过程。 结核分枝杆菌H37Rv作为DNA损伤和修复的生物标志物,显著诱导H2AX 丝氨酸-139磷酸化(γH2AX),但高温或利福平(抗结核分枝杆菌的一线药物)失活显著抑制了H37Rv对 γH2AX的诱导(图1 A、B)。检测81个Mtb分泌蛋白对两种DNA DSB修复途径——同源重组(homologous recombination, HR)和非同源末端连接(nonhomologous end joining, NHEJ)报告蛋白的影响,发现脲酶C (Urease C, UreC) (Rv1850)抑制HR和NHEJ (图1 C、D)。在Mtb感染的巨噬细胞中,UreC的缺失显著降低了γH2AX水平的诱导或γH2AX与DSBs共定位(图1 E),Mtb感染的巨噬细胞中UreC的缺失稳定了基因组(图1 F、G)。 在HEK293T细胞(常被称作“工具细胞”,实验中常使用它来进行慢病毒包装生产及滴度测定,细胞转染,条件培养基制作,蛋白表达验证等试验)或巨噬细胞中,单独过表达UreC并不会引起DNA损伤。在感染H37Rv的原代小鼠腹膜巨噬细胞中观察到微核显著增加,这是基因组不稳定的标志,但H37RvΔUreC的巨噬细胞的微核产生频率远低于感染野生型H37Rv的巨噬细胞(图1 H、I)。 图1 UreC是一种宿主DNA修复阻断剂 H37RvΔUreC的体外生长速度与野生型H37Rv无显著差异。UreC缺失显著降低了小鼠肺组织的组织病理学改变,导致其免疫细胞浸润减少,炎症病变减少,肺部的细菌负荷降低,而H37RvΔUreC与野生型UreC的互补可恢复这种损伤(图2 A-D)。集落形成单位(colony-forming unit, CFU)测定结果表明,H37Rv和H37RvΔUreC在感染后24小时后,H37RvΔUreC在细胞内数量显著减少(图2 E-H)。 图2 UreC促进Mtb细胞内存活 免疫沉淀和质谱分析鉴定UreC是RuvB样蛋白2 (RuvB-like protein 2, RUVBL2)(RUVBL蛋白参与转录调控、DNA损伤修复、细胞周期控制和应激适应)的相互作用蛋白(图3 A、B)。纯化蛋白的表面等离子体共振(surface plasmon resonance, SPR)实验显示,与RUVBL1(RUVBL2结合蛋白)相比,RUVBL2与UreC的结合亲和力更强(图3 C)。 用特异性抑制剂或小干扰RNA (small interfering RNA, siRNA)阻断RUVBL2,可减弱UreC介导的H37Rv诱导的H37Rv感染巨噬细胞中γH2AX的增强(图3 D、E)。RUVBL2与RAD51(RAD51 重组酶是同源重组 (HR) 的关键效应子)相互作用,通过稳定RAD51病灶形成介导HR修复。coIP分析显示,RUVBL1/2在HEK293T细胞中与RAD51相互作用,但UreC的共表达阻碍了RUVBL1/2与RAD51的相互作用(图3 F)。 图3 UreC与RUVBL2相互作用,消除RUVBL2与RAD51复合物的形成 感染H37RvΔUreC的巨噬细胞中,Ifnb和IFN刺激基因(包括Cxcl11、Ifit1bl1、Irf7和Isg15)的mRNA水平远低于感染H37Rv的巨噬细胞。UreC的缺失也显著降低了H37Rv感染巨噬细胞中IFN-β的产生(图4 A)。ELISA结果显示,UreC还能提高H37Rv感染小鼠肺组织或血清中IFN-β蛋白水平(图4 B、C)。 cGAS是Mtb胞质DNA传感器,能够产生2’3‘-环GMP-AMP (2',3'-cyclic GMP-AMP, cGAMP),进而激活STING诱导IFN-β。敲除Cgas或Sting均可显著降低Mtb诱导的Ifnb表达或IFN-β的产生(图4 D、E)。 Mtb感染的巨噬细胞积累脂滴,可作为细胞内杆菌的营养来源。本研究发现H37Rv促进泡沫细胞(泡沫细胞是吞噬大量脂肪的巨噬细胞或平滑肌细胞)形成,增加中性脂质含量,而UreC的缺失显著减少了H37Rv感染巨噬细胞中脂滴的积累(图4 H、I)。 泡沫细胞的形成主要是几种清道夫受体(scavenger receptor)(是吞噬细胞表面的一组异质性分子,至少以6种不同的分子形式存在)介导的。UreC的缺失导致清道夫受体A1 (scavenger receptor-A1, SR-A1)的表达明显降低(图4 J)。特异性siRNA抑制SR-A1的表达可消除Mtb H37Rv诱导的脂滴积聚,同时也取消了ΔUreC对脂滴积聚的抑制作用(图4 K、L)。 I 型IFN暴露会引发胆固醇摄取、脂质积累和泡沫细胞形成。IFN-β处理显著增强了未被感染的巨噬细胞和H37Rv感染巨噬细胞的泡沫细胞形成,消除了ΔUreC介导的对H37Rv诱导的脂滴积聚的抑制(图4 M、N)。与此一致的是,IFN-β缺乏显著降低了H37Rv诱导的脂滴积聚,并抵消了ΔUreC对感染原代小鼠腹腔巨噬细胞脂滴积聚的抑制作用(图4 M、N)。此外,IFN-β蛋白暴露诱导了原代小鼠腹膜巨噬细胞中SR-A1的表达,并消除了ΔUreC介导的对SR-A1表达的抑制(图4 O)。 图4 UreC通过IFN-β促进泡沫细胞形成 使用增加浓度的IFN-β处理巨噬细胞,发现IFN-β增加了H37Rv和ΔUreC感染的巨噬细胞中Mtb的细胞内存活率,并缩小了细胞内细菌负荷的差异,下调或敲除Ifnb仅在感染H37Rv的巨噬细胞中导致细菌载量降低,而在感染H37RvΔUreC的巨噬细胞中则没有(图5 A、D)。与此一致的是,Ifnar1、Stat1或Stat2的缺失也抑制了感染小鼠腹膜中H37Rv的细菌载量,但对H37RvΔUreC没有作用(图5 E、F)。用特异性抑制剂或siRNA抑制SRA1可显著降低巨噬细胞中H37Rv的细胞内存活,但对H37RvΔUreC没有影响(图5 G-J)。 图5 UreC通过IFN-β途径促进结核分枝杆菌的细胞内存活 Mtb UreC可以催化尿素水解生成氨和氨基甲酸酯,导致整体pH升高。事实上,UreC的缺失降低了H37Rv感染巨噬细胞的胞质pH值,表明UreC确实具有碱化作用。对脲酶进行结构分析显示,两个组氨酸残基在协调活性位点的两个镍离子方面很重要,这两个残基(H253A和H279A)在Mtb UreC中也是保守的。与UreC互补,感染H37RvΔUreC的巨噬细胞降低的胞浆pH升高,而与其两个脲酶缺陷突变体(H253A或H279A)互补却没有此效果(图6 A)。 H37RvΔUreC与UreC互补后的生长与H37Rv在感染巨噬细胞中的生长相似,而与其两个脲酶缺陷突变体(H253A和H279A)互补后无明显效果(图6 B、C)。与UreC互补也恢复了受感染的原代小鼠腹膜巨噬细胞中Mtb诱导的DNA损伤反应(DNA damage responses, DDRs)(图6 D、E)。 进行coIP实验发现,在HEK293T细胞中添加NH4Cl增强了UreC和RUVBL2之间的相互作用,但乙酸降低了它们之间的相互作用(图6 F、G)。在coIP实验中,只有野生型UreC与RUVBL2相互作用(图6 H)。NH4Cl的加入挽救了UreC (H253A)或UreC (H279A)与RUVBL2的相互作用,表明UreC和RUVBL2之间的相互作用依赖于UreC脲酶活性介导的胞质pH升高(图6 H)。 使用野生型H37Rv或H37Rv (ΔUreC + UreC)以及H37Rv (ΔUreC)或H37Rv (ΔUreC + H253A/H279A)感染对RUVBL1/2与RAD51之间的相互作用的影响也证明了上述结论(图6 I)。 图6 UreC依赖于它的脲酶活性 脲酶抑制剂的一个主要类别是羟肟酸衍生物,如乙酰羟肟酸(acetohydroxamic acid, AHA)。AHA明显抑制巨噬细胞中H37Rv的生长,而不抑制H37RvΔUreC的生长(图7 A、B)。 本研究通过斑马鱼-海洋分枝杆菌(M. marinum)感染模型评估了AHA对分枝杆菌发病机制的体内影响。与未经处理的斑马鱼相比,经AHA处理的感染海洋分枝杆菌的成年斑马鱼的细菌负荷要低得多(图7 C),感染后14天(dpi)低负荷或非坏死肉芽肿的比例增加(图7 D、E)。而这种处理对感染海洋分枝杆菌ΔUreC的斑马鱼没有效果(图7 F、G)。 为了研究AHA对一种耐药菌株感染发病机制的治疗作用,用成年斑马鱼感染了耐利福平的海洋分枝杆菌(M. marinum-RR)。AHA与阳性对照乙胺丁醇(ethambutol, EMB)效果相当,显著降低M. marinum-RR和坏死性肉芽肿的CFU(图7 H-J)。此外,在小鼠多药耐药感染模型中,以贝达喹啉(bedaquiline, BDQ)为阳性对照,经AHA灌胃的C57BL/6小鼠肺组织免疫细胞浸润较少,炎性病变较少(图7 K、L)。AHA处理小鼠肺组织中的细菌负荷远低于未处理小鼠(图7 M)。 图7 抑制UreC可促进分枝杆菌的清除 本研究发现结核分枝杆菌蛋白UreC作为宿主DNA修复抑制剂,激活I 型IFN通路,促进脂滴和结核分枝杆菌的细胞内存活。我们发现UreC与RUVBL2的直接相互作用阻碍了RUVBL1-RUVBL2-RAD51复合物的形成,从而抑制宿主HR介导的DNA修复。基因组不稳定性的增加激活了cGAS/STING通路,诱导IFN-β通路,IFN-β通路通过上调SR-A1的表达,促进了Mtb的脂滴形成和细胞内存活。此外,UreC的缺失或抑制显著损害了Mtb在巨噬细胞和体内的存活。 总之,本研究发现UreC抑制宿主DNA修复并促进结核分枝杆菌的细胞内存活,UreC可能是结核病预防和治疗的潜在靶点。结核分枝杆菌(Mycobacterium tuberculosis, Mtb)通常会触发宿主先天和适应性免疫细胞从而限制细菌生长。肺泡巨噬细胞首先对结核分枝杆菌感染产生应答,可通过吞噬作用、吞噬体-溶酶体融合、细胞凋亡和自噬等一系列机制消灭细胞内细菌。然而,作为一种成熟的细胞内病原体,Mtb通过进化毒力因子(如细胞壁成分和分泌的蛋白质和代谢物)来逃避或抑制宿主的抗菌机制,并促进细胞内感染成功进行,从而响应这些宿主的防御策略。
1、UreC是宿主DNA修复抑制剂
2、UreC促进Mtb在细胞内存活
3、UreC与RUVBL2互作
4、UreC通过IFN-β促进泡沫细胞形成
5、UreC通过IFN-β促进结核分枝杆菌存活
6、UreC依赖于它的脲酶活性
7、抑制UreC可促进分枝杆菌的清除