
发表期刊:Cell Metabolism
发表时间:2022年3月
影响因子:27.287
合作客户:复旦大学附属肿瘤医院
百趣提供服务:氧化三甲胺高通量靶标检测
三阴性乳腺癌(TNBC) 是一种侵袭性疾病,预后差,免疫治疗在患者中取得的成功有限。三阴性乳腺癌(TNBC)的四种亚型中,IM亚型的特点是在微环境中富集免疫激活细胞和免疫刺激因子,提示TNBC的IM亚型患者可能对免疫治疗有更好的反应。因此,迫切需要找到调节TNBC微环境、促进抗肿瘤免疫的因子。
本研究对FUSCCTNBC队列(n=360)的转录组、代谢组和微生物组数据进行了全面分析,发现TMAO通过诱导肿瘤细胞焦亡,从而增强TNBC体内CD8+T细胞介导的抗肿瘤免疫,提高免疫治疗疗效。该研究为微生物群-代谢-免疫相互作用提供了新的见解,并表明微生物代谢物,如TMAO或其前体胆碱,可能代表了一种新的治疗策略,以促进免疫治疗对TNBC的疗效。
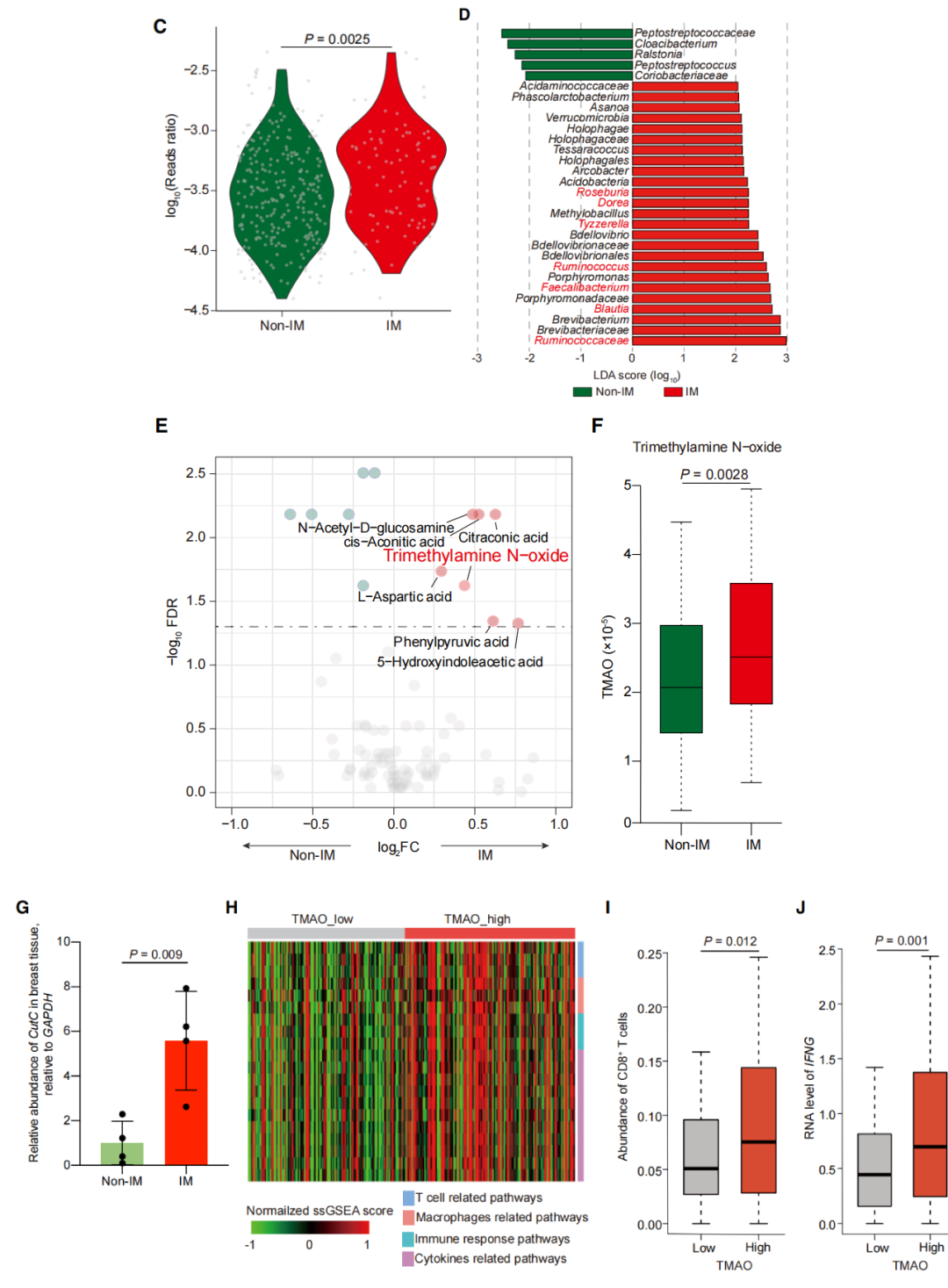
图1. 在TNBC中,微生物代谢物TMAO与免疫激活微环境相关
2.TMAO通过激活CD8+T细胞介导的抗肿瘤免疫来抑制肿瘤生长
构建小鼠66cl4TNBC细胞模型(图2A),表明肿瘤内联合注射TMAO显著促进CD8+T细胞和M1巨噬细胞的浸润,增强CD8+T细胞的功能并有效抑制三阴性乳腺癌的生长(图2A-2E)。说明肿瘤微环境中TMAO水平升高可有效增强抗肿瘤免疫,抑制肿瘤生长。
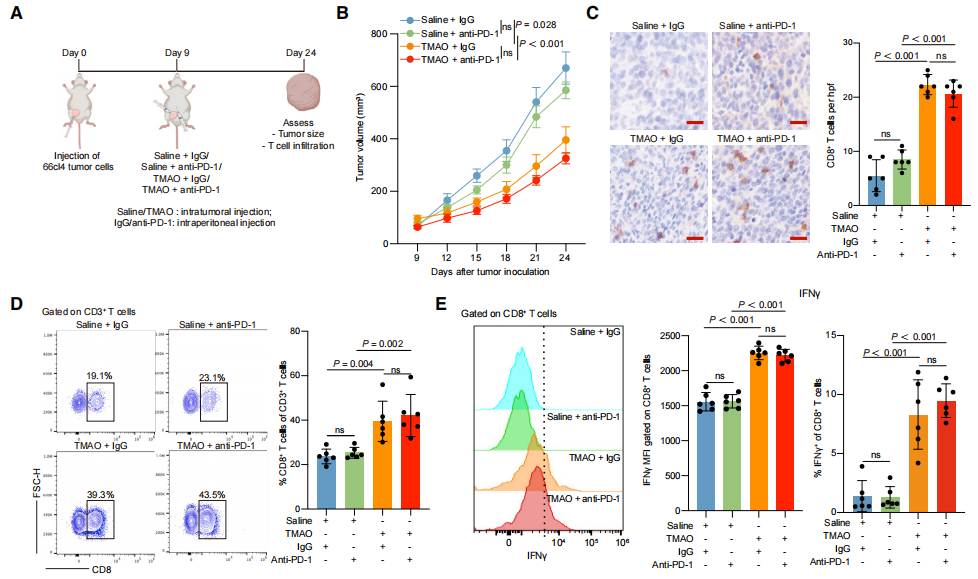
图2. TMAO通过激活CD8+T细胞介导的抗肿瘤免疫来抑制肿瘤生长
形态学水平上和乳酸脱氢酶释放试验显示TMAO处理的癌细胞发生焦亡(图3A、3B)。Western blot结果显示,参与细胞焦亡的两个关键蛋白——裂解的caspase3和GSDME在TMAO处理后表达上调(图3C)。用发夹RNA敲除Gsdme的表达,结果显示TMAO处理对植入shGsdme和植入表达了正常混乱shRNA的细胞株的小鼠的影响极小(图3G和3H)。敲除Gsdme阻断了TMAO诱导的CD8+T细胞抗肿瘤免疫增强和肿瘤生长抑制(图3I)。表明TMAO通过诱导gsdme介导的肿瘤细胞焦亡来激活TNBC的抗肿瘤免疫。
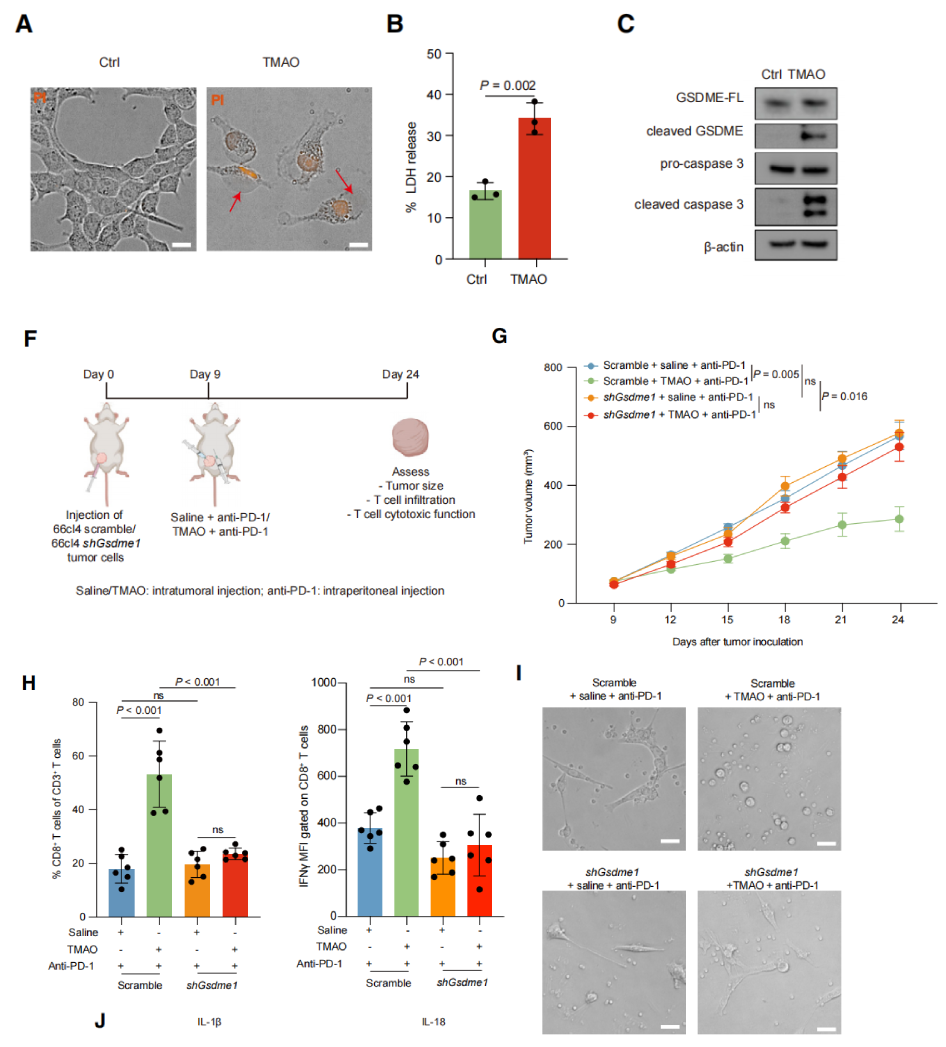
图3. TMAO诱导gsdme介导的肿瘤细胞焦亡
用小鼠模型进一步验证蛋白激酶R-like内质网激酶(PERK)在体内激活细胞焦亡的能力(图4E)。结果表明TMAO处理显著抑制肿瘤生长,促进CD8+T细胞浸润,而PERK抑制剂减弱了TMAO诱导的抗肿瘤免疫(图4F和4G)。用PERK抑制剂治疗小鼠,可在体内阻止TMAO诱导的内质网应激的PERK依赖通路的激活和GSDME介导的细胞凋亡(图4H),进而抑制CD8+T细胞浸润。说明TMAO激活了PERK介导的内质网应激,从而导致caspase-3的激活和GSDME介导的肿瘤细胞焦亡。
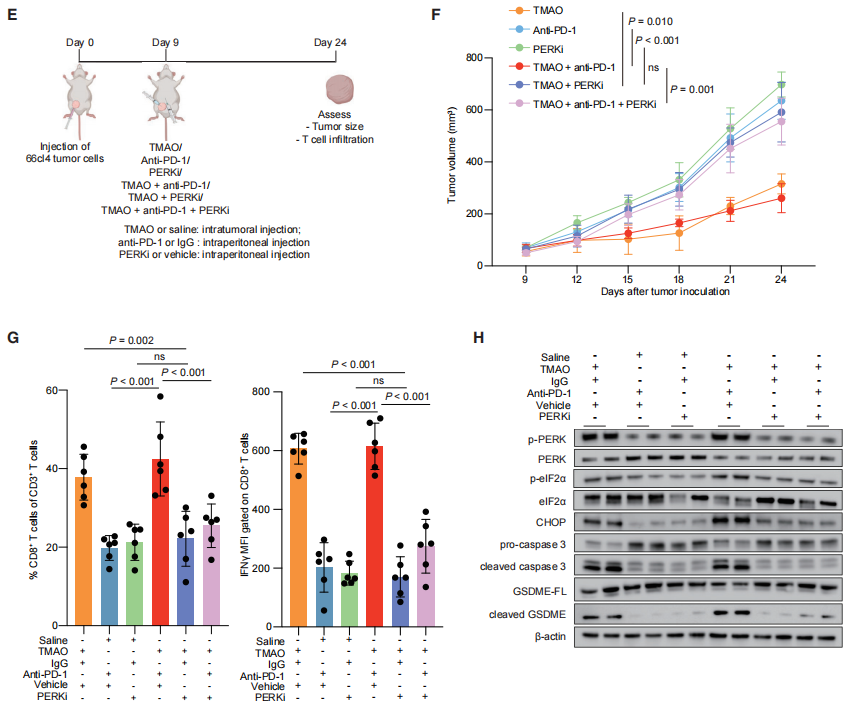
图4. PERK是TMAO诱导细胞焦亡所必需的
收集使用抗pd-1抑制剂治疗5个周期患者的血浆样本进行临床评估,发现高血浆TMAO水平的患者对免疫治疗反应性更好(图5A-5E)。将携带66cl4或4T1乳腺癌的小鼠腹腔注射TMAO以诱导高血浆TMAO(图5F),证实提高血浆TMAO水平可以有效抑制小鼠肿瘤的生长(图5F-5I)。
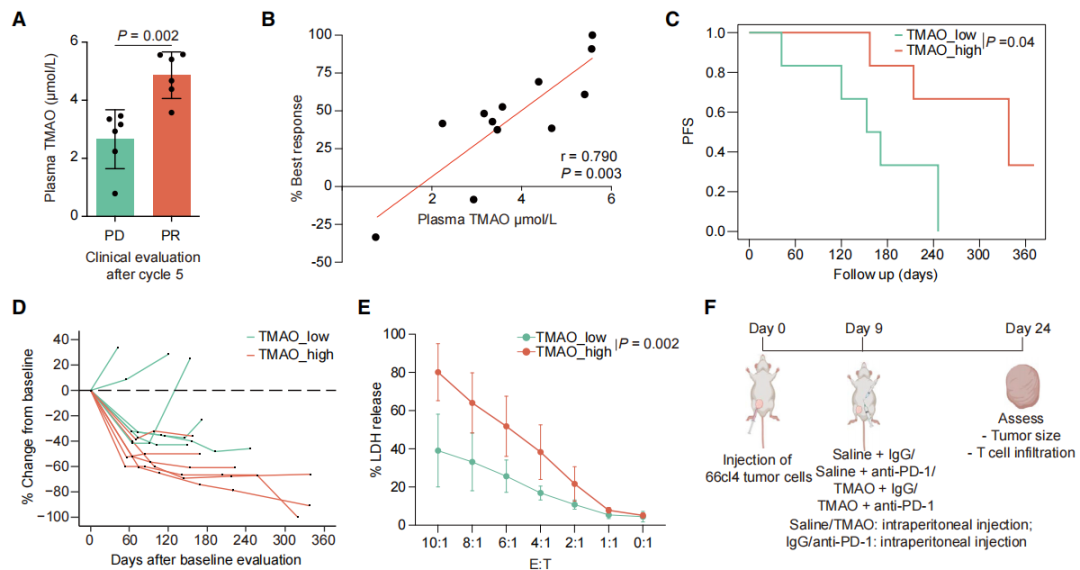
图5. 高血浆TMAO与TNBC患者免疫治疗效果改善相关
研究FUSCCTNBC队列中TMAO与代谢前体的相关性发现胆碱水平与TMAO呈正相关(图6A)。使用富含胆碱的饮食和3,3-二甲基-1-丁醇(DMB)建立小鼠模型中(图6B),发现食用富含胆碱的饲料的小鼠肿瘤TMAO水平更高,肿瘤生长速率更低(图6C和6D),肿瘤组织中CD8+T细胞的浸润和功能增加,而这一作用被DMB联合治疗阻断(图6E和6F)。说明富含胆碱的饮食可上调小鼠肿瘤组织中的TMAO,并通过增强抗肿瘤免疫抑制肿瘤生长。
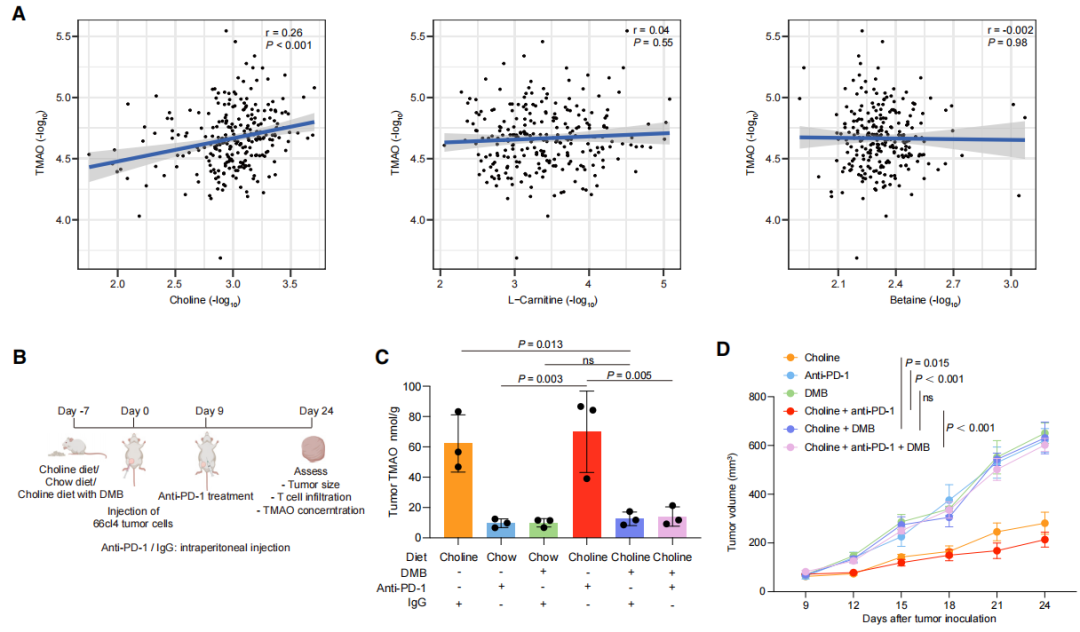
图6. 富含胆碱的饮食可通过共生微生物群上调肿瘤TMAO水平
本研究提供了具有共生微生物群影响宿主肿瘤免疫力的能力的新视角,表明微生物代谢物,如TMAO或其前体胆碱,可能代表了一种新的治疗策略,以促进免疫治疗对TNBC的疗效,说明TMAO可能具有增强TNBC中免疫疗法疗效的临床潜力。
百趣生物为本研究提供了氧化三甲胺靶标检测分析服务,定性定量准,构建物质标准曲线,提供物质的绝对含量;技术成熟稳定、分辨率高、选择性好;团队经验丰富,有专业的研发和数据分析团队。
有兴趣采用定制靶标进行样本检测分析的老师,欢迎垂询服务热线:400-664-9912或在线咨询。
文献下载链接:
提取码:0000