
文章标题:Streptococcus anginosus promotes gastric inflammation, atrophy, and tumorigenesis in mice
客户单位:香港中文大学
期刊:Cell
影响因子:64.5
百趣提供服务:蛋白质组学
胃癌(Gastric cancer, GC)是全球第五大常见癌症,也是导致癌症死亡的主要原因。幽门螺杆菌(Helicobacter pylori, H. pylori)是胃癌的主要危险因素,被列为I型致癌物。但在感染幽门螺杆菌的个体中,只有1%-3%的人最终发展为GC,这表明还有其他因素参与其中。一些新的证据表明,大量的非H. pylori微生物群存在于胃粘膜中,它们的失控可能在胃癌发生中起作用。然而,与胃癌发生相关的非H. pylori驱动细菌尚未被发现。
2024年1月30日,香港中文大学于君老师团队在Cell在线发表题为"Streptococcus anginosus promotes gastric inflammation, atrophy, and tumorigenesis in mice"的研究论文,该研究发现GC患者胃粘膜中有丰富的咽峡炎链球菌(Streptococcus anginosus, S.anginosus)。S.anginosus定植于小鼠胃并引起急性胃炎。在常规小鼠模型中,S.anginosus感染可诱发进行性慢性胃炎、壁细胞萎缩、粘液化生和异型增生,并在无菌小鼠中得到证实。此外,在致癌物诱导的胃肿瘤形成和YTN16 GC细胞同种异体移植中,S.anginosus加速了GC进展。S.anginosus可破坏胃屏障功能,促进细胞增殖,抑制细胞凋亡。作者进一步进行了机制研究,采用Pull-Down实验来确定S.anginosus与宿主受体结合的细菌粘附素,通过质谱检测到三种蛋白并找到关键膜蛋白TMPC(百趣生物为其提供蛋白质谱检测服务),TMPC可与胃上皮细胞上的膜联蛋白Annexin A2(ANXA2)受体相互作用。TMPC与ANXA2相互作用诱导丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)活化。ANXA2基因敲除后,S.anginosus对MAPK的诱导作用被阻断。本项研究揭示了S.anginosus是一种病原体,通过与TMPC-ANXA2-MAPK轴上的胃上皮细胞直接相互作用而促进胃肿瘤的发生。
1、 胃炎患者胃粘膜中富含S.anginosus
作者首先采用自己内部的16S rRNA基因测序数据集分析了胃癌发生的不同阶段中S.anginosus的丰度。与浅表性胃炎(superficial gastritis, SG, N=110)相比,萎缩性胃炎(atrophy gastritis, AG, N=117)和肠化生(intestinal metaplasia(IM, N=45)患者的S.anginosus水平明显升高,在GC(N=39)患者中达到最高水平(图1 A)。S.anginosus对胃部感染长期影响,通过动物模型实验,将感染模型延长到3、6、9和12个月,结果发现 S.anginosus感染小鼠3个月后诱发慢性胃炎(图1 B和C)。
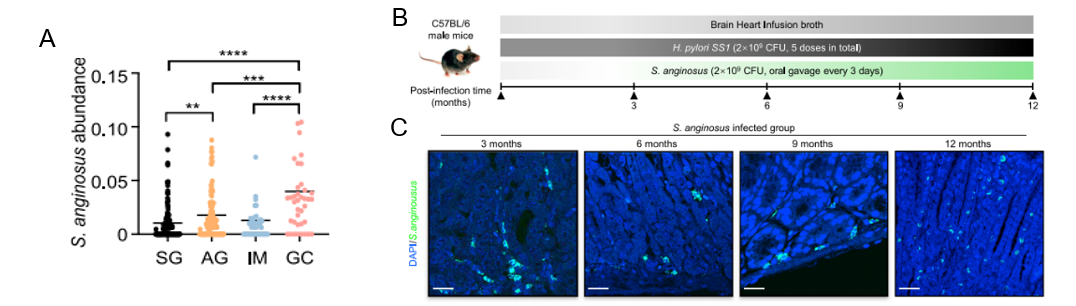
图1 S.anginosus在不同类别胃活检样本中的丰度分布图及其染促进小鼠慢性胃炎
2、 S.anginosus诱导小鼠产生胃炎萎缩化生异型增生序列
胃肿瘤的发生过程沿着萎缩-化生-异型增生序列的癌前病变进行,胃炎是一个主要的危险因素。既然S.anginosus可诱发慢性胃炎,那么作者思考:长期感染是否会引发胃粘膜的癌前病变。通过研究发现,在感染9个月时,S.anginosus感染引起轻度壁细胞萎缩,12个月时发展为中度至重度萎缩(p=0.01),并检测到粘液化生,形成了低级别的不典型增生(图2 A~D)。对小鼠胃组织的荧光原位杂交(Fluorescence in situ hybridization, FISH)分析表明,与非化生区相比,S.anginosus在化生/异型增生区域中较为丰富。以H. pylori为阳性对照,H. pylori可更快地引起胃萎缩;但是在12个月时,粘液化生的数量低于S.anginosus诱导的,并且没有发现异型增生(图2 A、B和E)。在感染9个月和12个月后,与BHI对照组相比,S.anginosus引起胃萎缩(P<0.05)。为了确证粘液化生,作者进行了阿尔新蓝的组织学染色,这是一种常用的指示胃中杯状细胞的染料,用于诊断IM。在12个月龄时,感染链球菌的小鼠胃粘膜内可见阿尔辛蓝阳性细胞,而BHI对照组小鼠胃粘膜内未见阿尔辛蓝阳性细胞。作者还进行了化生标记物单叶格里夫尼亚凝集素II(Griffonia simplicifolia lectin II, GSII)的免疫荧光染色(图2 F)。与H&E染色下的化生改变一致,感染后12个月,胃腺内GSII阳性细胞增加。
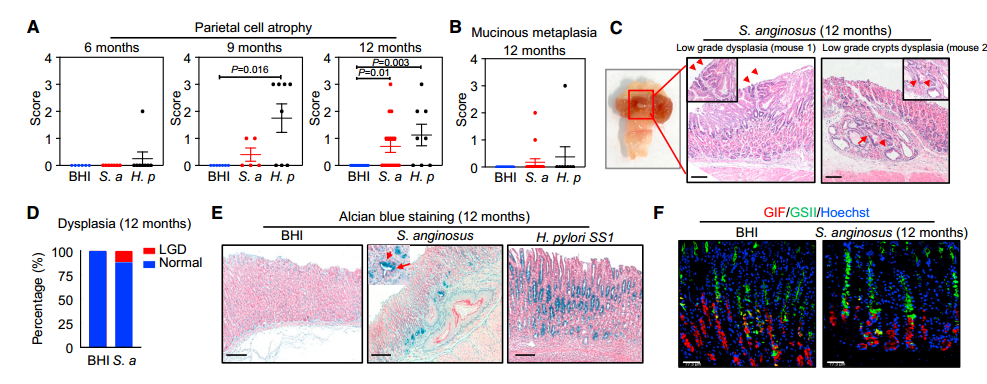
图2 S.anginosus引起小鼠胃萎缩、化生、异型增生
3、 S.anginosus促进胃肿瘤的发生
作者通过建立N-甲基-N-亚硝脲(N-methyl-N-nitrosourea, MNU)诱导的GC小鼠模型(图3 A)来阐明S.anginosus在胃肿瘤发生中的作用。结果表明:MNU处理9个月后,胃窦部出现胃部病变。感染S.anginosus的小鼠肿瘤发生率(10/11)显著高于对照组(4/13)和幽门螺杆菌感染小鼠(12/18,P<0.003)(图3 B)。与只接受MNU处理的对照小鼠相比,感染S.anginosus的小鼠的肿瘤数量(p=0.006)和肿瘤大小(p<0.05)都显著增加(图3 C)。组织学检查显示,36.4%的小鼠有高度不典型增生(high-grade dysplasia, HGD),高于单独接受MNU处理的小鼠(15.4%)(图3 D),与H. pylori感染的小鼠(22.2%HGD和5.6%腺癌)相当。Ki-67染色显示,与MNU处理的对照小鼠相比,S.anginosus的小鼠细胞增殖更高(p<0.05)(图3 E)。这些发现共同推断,S.anginosus加速了MNU诱导的小鼠胃肿瘤的发生。
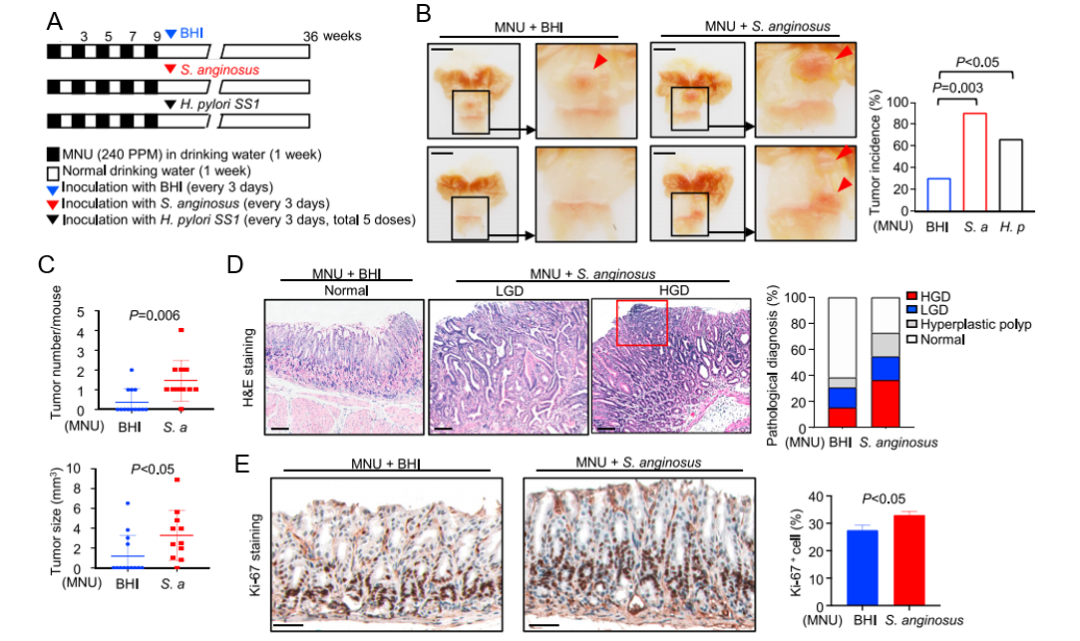
图3 S.anginosus加速小鼠胃癌的发生
4、TMPC-Annexin A2轴介导S.anginosus定植并激活MAPK信号转导
在小鼠胃粘膜中发现了S.anginosus的定植后,接着对该细菌的黏附特性进行了研究。通过细菌附着和入侵法以及扫描电子显微镜(scanning elec-tron microscopy, SEM)发现,S.anginosus (<1 μm,球状)附着在AGS和GES-1细胞表面,具有清晰的病原-宿主界面。这表明S.anginosus可能通过与胃上皮细胞直接相互作用而发挥致癌作用。
进一步通过biotin-pull-down、GST-pull-down,COIP等互作实验以及sgRNA细胞实验对S.anginosus附着和侵袭胃上皮细胞的潜在机制进行研究,发现和证实了S.anginosus通过其表面蛋白TMPC与胃上皮细胞上的ANXA2受体结合,介导S.anginosus对胃上皮细胞的定植,在肿瘤发生中起重要作用(图4 A~G)。
为了进一步研究S.anginosus诱发胃癌的下游信号机制,作者对感染S.anginosus的普通小鼠(12个月)和对照组小鼠的胃组织进行了rna-seq测序以及WB验证等实验,最终发现和证实了S.anginosus通过TMPC-ANXA2相互作用促进MAPK信号转导,进而引起了其在胃上皮细胞中的促癌作用(图4 L~Q)。
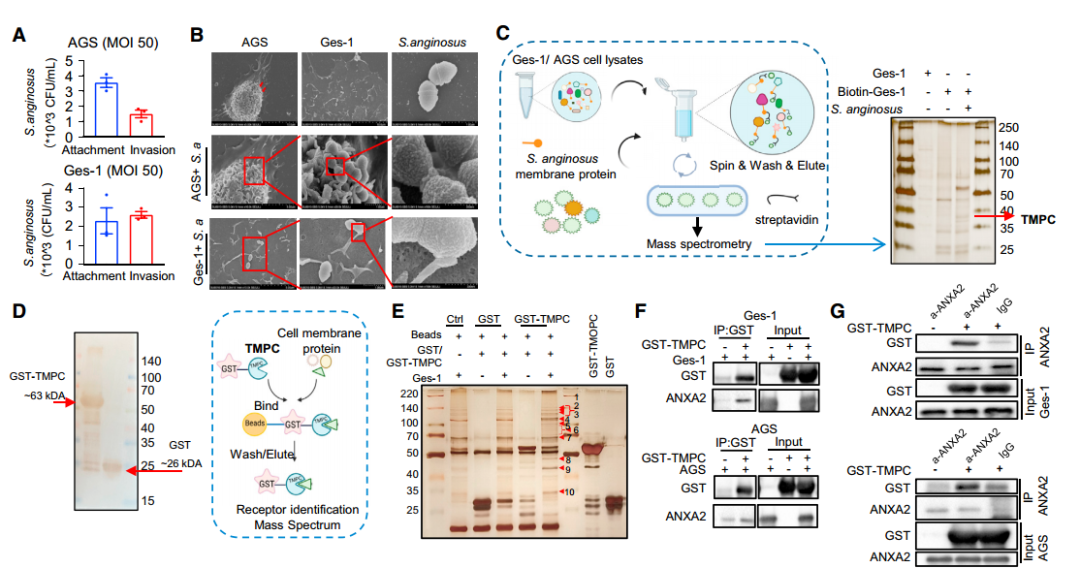
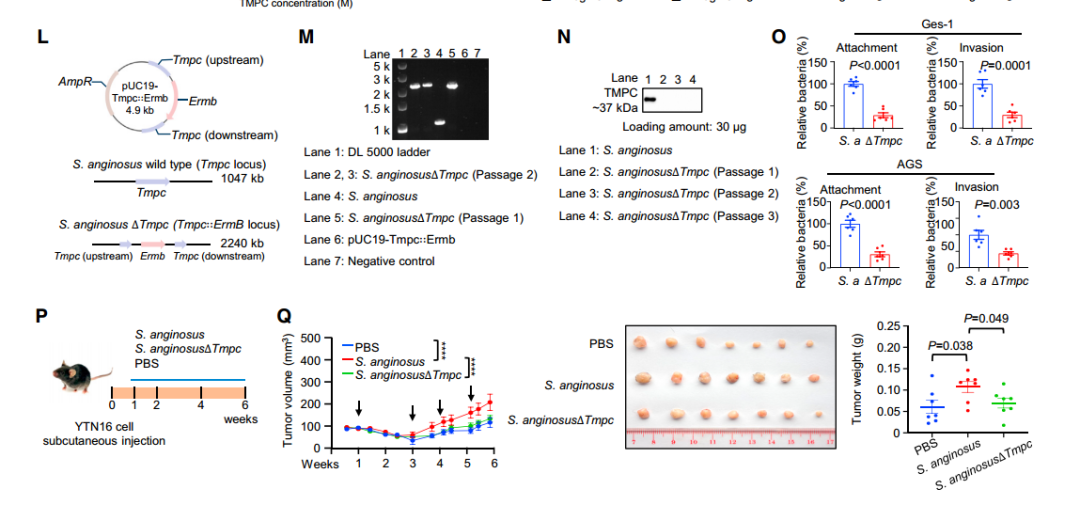
图4 S.anginosus通过TMPC-ANXA2轴激活MAPK信号通路促进胃肿瘤的发生
综上所述,作者鉴定了一种非H. pylori驱动细菌S.anginosus会促进胃肿瘤的发生。在小鼠模型中,S.anginosus感染诱导胃炎和癌前病变、萎缩化生-异型增生序列,并加速胃肿瘤的发生。进一步发现了S.anginosus表面毒性因子TMPC与胃上皮细胞表面的ANXA2结合,引起细菌的附着、侵袭,以及致癌基因MAPK信号的下游激活。本项研究提供了S.anginosus在胃癌发生过程中作为致病病原体的证据。